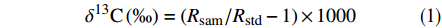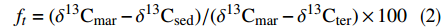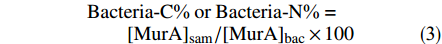Study on the distributions of amino sugars and their indications to organic matter sources and degradations in the surface sediments of the Bohai Sea
-
摘要:
本文对渤海表层沉积物中氨基糖(ASs)的含量和组成进行了调查,并结合总有机碳(TOC)、总氮(TN)、稳定碳同位素(δ13C)和粒度等参数对渤海沉积有机物(SOM)的来源和细菌源有机质的贡献进行了探讨。渤海表层沉积物中ASs的含量为0.22~1.89 μmol/g,平均值为(1.01 ± 0.52)μmol/g。双端元模型结果表明,渤海表层沉积物中陆源有机质的贡献(ft)为28.1%~42.8%,并且ft值随着距黄河口距离的增加而逐渐减小。有机碳含量较低的黄河泥沙的沉积可能是导致黄河口和渤海海峡附近海域表层沉积物中TOC、TN和ASs含量较低的原因。而在受黄河影响较小的渤海其他海域中,TOC、TN和ASs的含量较高,这可能与黏土矿物和海洋初级生产力对SOM的影响有关。ASs对TOC和TN的贡献(AS-C%和AS-N%)分别为(1.5 ± 0.7)%和(1.9 ± 0.9)%。氨基葡萄糖/氨基半乳糖(GlcN/GalN)的值低于3,表明细菌源有机质可能是渤海表层沉积物中ASs的主要来源。渤海表层沉积物中细菌源有机质对TOC和TN的贡献(Bacteria-C%和Bacteria-N%)分别为(10.7 ± 8.3)%和(12.6 ± 9.6)%。
Abstract:The contents and compositions of amino sugars (ASs) were investigated in the surface sediments of the Bohai Sea. Combined with analysis of total organic carbon (TOC), total nitrogen (TN), stable carbon isotope (δ13C) and grain size, the sources of sedimentary organic matters (SOM) and bacterial contributions were studied. The concentrations of ASs ranged from 0.22 to 1.89 μmol/g, with an average value of (1.01 ± 0.52) μmol/g in the surface sediments of the Bohai Sea. According to the two end-members mixing model, the fractions of terrigenous organic matter (ft) ranged from 28.1% to 42.8% in the surface sediments, which gradually decreased from the Yellow River Estuary to the sea. The deposition of “low organic carbon” sediments of the Yellow River may be responsible for low TOC, TN and ASs contents in the surface sediments of the Yellow River mouth and the Bohai Strait. However, the relatively high contents of TOC, TN and ASs may be related to the effects of clay minerals and primary production on SOM in the sites where less affected by the Yellow River. The average contributions of ASs to TOC and TN (AS-C% and AS-N%) were (1.5 ± 0.7)% and (1.9 ± 0.9)%, respectively. The ratios of glucosamine to galactosamine (GlcN/GalN) below 3, indicating that bacterial organic matter may be the main source of ASs in the surface sediments of the Bohai Sea. The mean contributions of bacterial organic matter to TOC and TN (Bacteria-C% and Bacteria-N%) in the surface sediments of the Bohai Sea were (10.7 ± 8.3)% and (12.6 ± 9.6)%, respectively.
-
Keywords:
- sediments /
- amino sugars /
- distribution /
- Bohai Sea
-
河口及陆架海区是沉积有机物(SOM)的主要堆积区,超过90%的有机碳沉积在此区域,在全球的碳循环过程中起着重要作用[1]。渤海是中国东部典型的半封闭式陆架浅海,平均水深为18 m,仅东部通过渤海海峡与北黄海相通。渤海受黄河、滦河和辽河等河流共同影响,其中,黄河是渤海入海物质的主要来源。1952-2010年,黄河平均每年向海洋输送约7.22 × 108 t沉积物,这些沉积物以粉砂质砂和黏土质砂为主[2]。自20世纪50年代起至2013年,黄河颗粒有机碳的年均入海量由4.11 Tg/a下降至0.73 Tg/a[3]。因此,对渤海SOM的组成和分布进行研究,有助于深入认识大河影响下陆架边缘海中沉积有机碳的“源-汇”关系。
氨基糖(ASs)作为单糖的一种衍生物,同时参与海洋中的碳、氮循环,是海洋中重要的生源有机质,其含量和组成信息能够有效地反映有机质的来源并进一步估算细菌源有机质对总有机质的贡献。在海洋中,针对溶解有机物[4]、颗粒物[5]和沉积物[6]中的ASs的研究已广泛开展,研究区域涉及大洋[5]、近海[7]、海湾[8]和重要河口[9]。但是,关于中国近海海域中ASs的研究相对匮乏,仅有少量研究[7, 9-10]有所涉及。例如,Lahajnar等[10]调查了南海沉降颗粒物中ASs的通量在季节、年际和空间上的差异。Wu等[9]将珠江口沉积物按粒径分为三个部分(超滤溶解有机物、细颗粒物和粗颗粒物),研究发现ASs对总有机碳的贡献(AS-C%)随着沉积物粒径的减小而增加;Ren等[7]调查了东海表层沉积物中ASs的含量和组成,探讨了影响有机质来源、活性和降解状态的因素,并估算了细菌源有机质的贡献。调查沉积物中ASs的来源和分布,有助于进一步认识ASs对SOM的来源和保存的指示意义。本文对渤海表层沉积物中ASs的含量和组成进行了调查,并结合总有机碳(TOC)、总氮(TN)、稳定碳同位素(δ13C)和粒度等参数对渤海SOM的来源和细菌源有机质的贡献进行了探讨。
1 材料与方法
1.1 样品采集
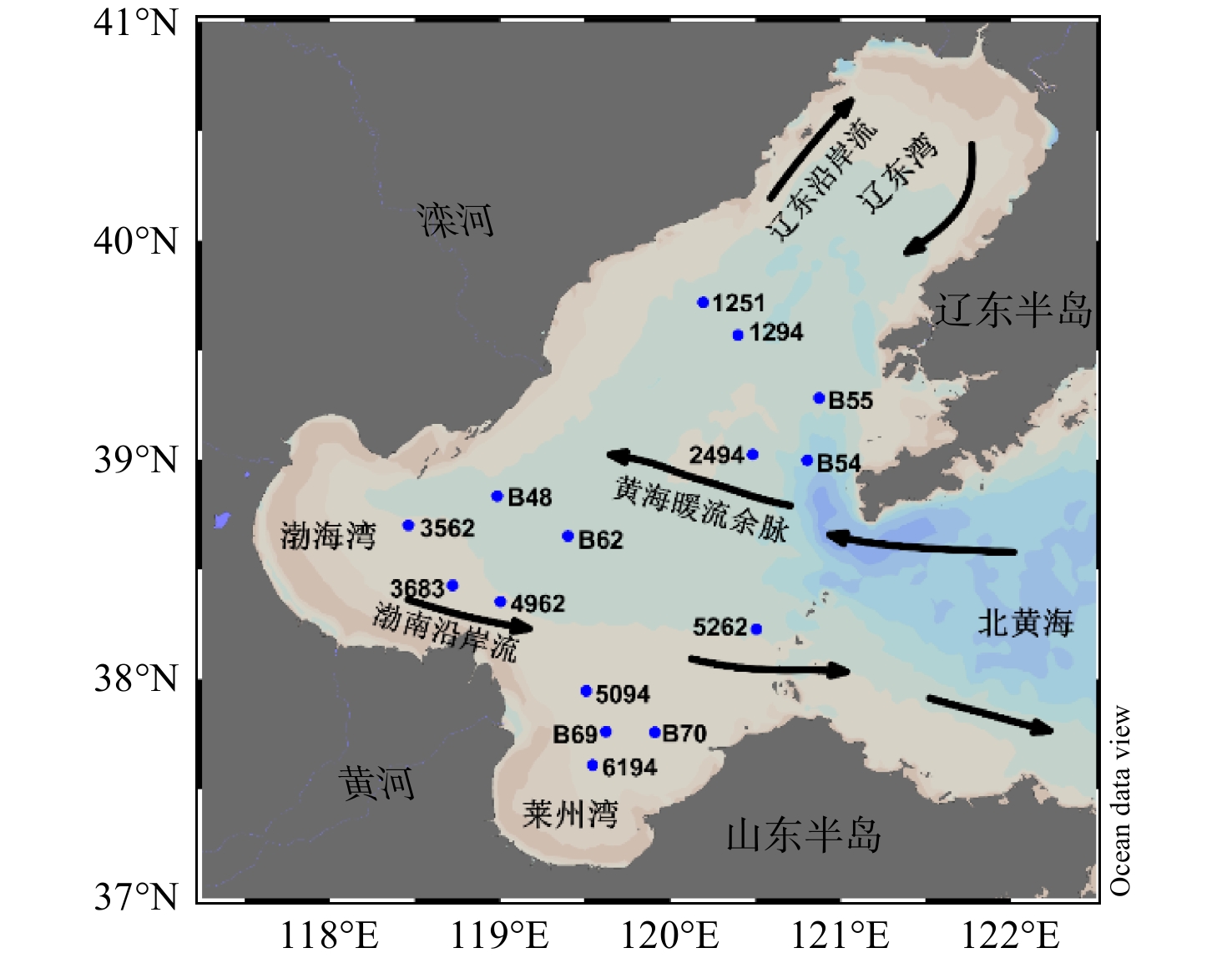
分别于2017年9月和2019年5月对渤海海域进行调查,共采集15个表层沉积物样品,采样站位如图1所示。所有沉积物样品使用箱式采泥器从海底采集至船上,表层沉积物(0~1 cm)用450 ℃灼烧处理过的无污染的铝箔纸包裹后封存在封口袋中,在−20 ℃条件下冷冻保存直至分析。
1.2 样品分析
1.2.1 TOC、TN和δ13C分析
将冷冻干燥后的沉积物样品进行研磨,过100目筛。用十万分之一分析天平准确称取一定量(30~50 mg)匀质化的沉积物样品于银杯中,用少量Milli-Q水将沉积物润湿,然后放置在盛有浓盐酸的干燥器内,熏蒸8 h。待样品中所有碳酸盐被完全去除后,将样品置于50 ℃烘箱中,烘至恒重。用锡杯将干燥好的样品包好,上机测定。CHN元素分析仪(Perkin-Elmer 2400 Ⅱ,德国)与同位素比例质谱仪(Isoprime 100,英国)联用同时测定沉积物样品的TOC、TN和δ13C值。TOC和TN分析所使用的标准品为土壤标准(0.732% C;0.064% N),平均标准偏差分别为0.02%和0.01%(n=6)。δ13C校正使用的是Vienna Peedee Belemnite(V-PDB)标准,计算公式如下:
$$ {\delta ^{13}}{\rm{C}}\left( \text{‰} \right) = ({R_{{\rm{sam}}}}/{R_{{\rm{std}}}} - 1) \times 1000 $$ (1) 式中:Rsam和Rstd分别为沉积物样品和标准样品的13C/12C值。δ13C分析的平均标准偏差为0.2‰(n=6)。
1.2.2 沉积物粒度分析
称取一定量(约1 g)冻干但未研磨的沉积物,用15 mL 30%(v/v)H2O2去除样品中的有机碳后,加入5 mL稀盐酸去除碳酸盐,离心并用Milli-Q水清洗,超声30 min后上机测定。沉积物样品的粒度采用激光粒度分析仪(Mastersizer 2000,英国)进行分析,分析的平均标准偏差为3%(n=6)。将沉积物根据粒径划分为以下3个粒级:砂(> 63 μm)、粉砂(4~63 μm)和黏土(< 4 μm)。
1.2.3 ASs分析检测
海洋沉积物中ASs的测定采用的是气相色谱-氢火焰离子化检测器(GC-FID)的方法。准确称取一定量(约0.4 g)匀质化的沉积物样品于安瓿瓶中,加入10 mL 6 mol/L HCl后密封,在105 ℃条件下水解8 h。冷却至室温后加入肌醇作为内标1,离心,其上清液全部转移至梨形瓶中,旋转蒸发干燥,残余物溶解于Milli-Q水中,用KOH溶液调节pH至6.6~6.8。再次离心,将上清液转移至梨形瓶中,再次旋转蒸发干燥。将残余物溶解于无水甲醇中,离心去除不溶解的盐,上清液在N2下吹扫干燥。将N2吹扫后的残余物溶于Milli-Q水中,加入N-甲基氨基葡萄糖作为内标2。另取3个样品瓶,每个瓶中加入ASs标准溶液、内标1、内标2和Milli-Q水,用Parafilm覆盖瓶口(扎孔),真空冷冻干燥8 h。ASs的衍生化采用的是糖腈乙酸酯化衍生法,具体操作如下:在干燥完成后的样品中加入300 μL衍生化试剂,70 ℃~80 ℃条件下反应30~35 min,冷却至室温后,加入1 mL乙酸酐,在70 ℃~80 ℃下再次反应20 min,再加入1.5 mL二氯甲烷,振荡后加入1 mL 1 mol/L HCl,剧烈涡旋30 s后离心,弃去上层溶液,再用1 mL Milli-Q水重复洗涤3次,剩余液体用N2吹扫干燥,将残余物最终溶解于200 μL乙酸乙酯-正己烷混合溶剂(v∶v=1∶1)中。
ASs衍生物采用GC-FID进行分离检测。色谱柱为HP-5气相色谱毛细管柱(30 m × 0.25 mm × 0.25 μm),分流比为30∶1,载气为高纯N2,载气流速为0.8 mL/min,进样体积为1 μL,柱头压力为110 kPa,进样口和检测器温度分别为250 ℃和300 ℃。程序升温过程为:柱温以10 ℃/min的速度从120 ℃升至250 ℃,并维持2.5 min,再以20 ℃/min的速度升温至270 ℃,在270 ℃维持6 min。ASs根据保留时间定性,利用内标法定量。用于定量的内标物为肌醇,N-甲基氨基葡萄糖作为内标物用于回收率的计算。氨基葡萄糖(GlcN)、氨基半乳糖(GalN)和氨基甘露糖(ManN)的回收率为>90%,胞壁酸(MurA)的回收率为>80%。GlcN、GalN、ManN和MurA的分析平均标准偏差分别为2%、3%、7%和10%(n=6)。
2 结果与讨论
2.1 表层沉积物中TOC、TN、δ13C和粒度组成
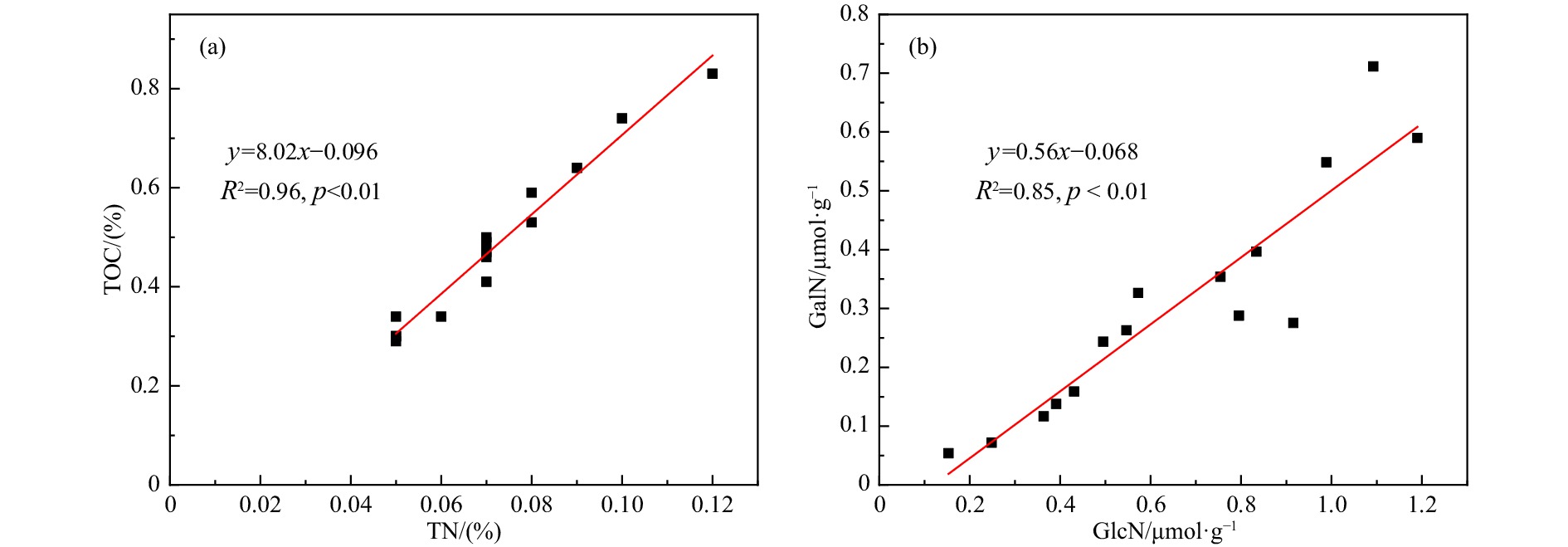
渤海表层沉积物中TOC的含量为0.29%~0.83%,平均值为(0.48 ± 0.16)%;TN的含量为0.05%~0.12%,平均值为(0.07 ± 0.02)%,与高立蒙等[11]在渤海的调查结果一致。整体而言,靠近黄河口和渤海海峡海域的表层沉积物中含有较低的TOC和TN,而在西北部靠近辽东湾海域的表层沉积物中TOC和TN含量较高(图2)。TOC和TN的最高值均出现在1251站位,而最低值均出现在5262站位。渤海表层沉积物中TOC和TN的含量具有显著的相关性(R2=0.96,p<0.01,图3a)。C/N的范围为5.7~7.4,其低值主要集中在黄河口和渤海海峡附近海域(图2)。另外,渤海表层沉积物主要以粉砂为主,其中值粒径为6.3~116.7 μm,平均值为(36.8 ± 32.7) μm。渤海表层沉积物类型和粒径的分布特征与该区域之前的研究结果一致[12]。细粒径沉积物(由黏土和粉砂组成)主要分布在渤海湾(如站位3562)和滦河口外靠近辽东湾的海域(如站位1251),而粗粒径沉积物(以砂质沉积物为主)主要出现在辽东和渤中浅滩(如站位2494)(图2)。
渤海海域表层沉积物中δ13C的范围为−23.08‰~−22.02‰。黄河口附近海域表层沉积物中δ13C较亏损,约为−22.90‰(图2)。为评估陆源和海源有机碳对SOM的影响,本文采用二端元混合模型计算了陆源有机碳的相对贡献(ft),计算公式如下:
$$ {f_t} = ( {{\delta ^{13}}{{\rm{C}}_{{\rm{mar}}}} - {\delta ^{13}}{{\rm{C}}_{{\rm{sed}}}}} )/( {{\delta ^{13}}{{\rm{C}}_{{\rm{mar}}}} - {\delta ^{13}}{{\rm{C}}_{{\rm{ter}}}}} ) \times 100 $$ (2) 式中:δ13Cmar和δ13Cter分别表示海洋和陆地端元中δ13C的值;δ13Csed为沉积物样品中δ13C的值。在渤海中选用的海洋和陆地端元值分别为−20.0‰和−27.0‰。(−20.0 ± 1.0)‰为全球海洋平均δ13C值,并且接近渤海湾浮游植物的δ13C值[13];而−27.0‰接近中国北方C3植物的δ13C值,并且与黄河的δ13C值接近[14]。通过计算得知,渤海表层沉积物中ft为28.1%~42.8%,在黄河口附近陆源有机质的占比大于40%,随着距河口距离的增加而逐渐减少(图2)。
2.2 表层沉积物中ASs的分布和组成
渤海表层沉积物中ASs的含量为0.22~1.89 μmol/g,平均值为(1.01 ± 0.52)μmol/g。ASs在渤海的分布呈现出西北高东南低的趋势,具体表现为靠近黄河口(如站位4962、3683和6194)和渤海海峡(如站位5262和2494)的海域含量较低,而在滦河口外靠近辽东湾的海域(如站位1251)含量较高(图2)。与其他近海海域沉积物中ASs的含量比较发现,渤海表层沉积物中ASs的含量与孟加拉湾[15]的调查结果相当,但略低于其他海域的调查结果[7, 16]。在渤海表层沉积物中,GlcN的相对含量较高,占总ASs含量的(64.8 ± 5.3)%;GalN次之,约占(28.6 ± 4.8)%;ManN和MurA的占比相对较少,分别为(5.5 ± 3.4)%和(1.1 ± 0.9)%。除站位5262和2494外,其他站位的GlcN/GalN的值均< 3。表层沉积物中AS-C%和ASs对TN的贡献(AS-N%)分别为0.5%~2.9%和0.6%~3.7%。滦河口和辽东浅滩附近海域的AS-C%和AS-N%值略高于其他区域(图2)。
2.3 渤海表层沉积物中SOM的分布特点及其影响因素
在本调查中,ft的数值以黄河口为高值中心向四周辐射变小,表明黄河口及其邻近海域是陆源有机质的主要沉积区域,相应的沉积物中陆源有机质的贡献率随着距河口距离的增加而逐渐降低。C/N被广泛应用于指示海洋中有机质的来源。一般而言,海洋源有机质的C/N较小,其范围为5~7;而陆源有机质因多含纤维素,其C/N相对于海源有机质高(> 15)[17]。然而,在本次调查中C/N的分布没有呈现出与ft相同的趋势。在受黄河影响较大的莱州湾和渤海海峡附近海域出现了C/N低值,这表明该区域SOM主要来源于海洋自身生产。此区域较低的C/N可能与无机氮在沉积物上的吸附有关。TOC和TN的线性拟合方程也证实了渤海表层沉积物中大量无机氮的存在(图3a)。陈沛沛等[18]对2009-2011年黄河下游水体中营养盐的分析表明,受沿岸农作物栽培过程中化肥农药使用的影响,黄河下游水体中溶解无机氮的浓度全年保持较高水平(190~393 μmol/L)。同时,此区域沉积物粒径较小,细颗粒物具有较大的比表面积并携带负电荷,有利于NH4+的吸附。因此,大量的无机氮随黄河水进入渤海并吸附到颗粒物上沉积到海底,掩盖了原有的C/N结果,混淆了其指示作用。另外,有机质的C/N会随矿化作用的进行而发生改变。一方面,细菌会优先降解海洋有机质中的有机氮,导致C/N升高[19];另一方面,富氮的细菌源有机质的存在也可能会使沉积物的C/N下降。细菌的作用会改变陆源和海源有机质原有的C/N,因此,在使用C/N指示海洋环境中有机质的来源时需谨慎,应该注意此海域中无机氮和细菌作用对TN的影响并结合其他参数(如δ13C)进行讨论。
在黄河口外围海域,沉积物类型多为黏土质粉砂,TOC和ASs含量较低,这可能因为黄河中90%的悬浮颗粒物来源于黄土高原,这些土壤颗粒物粒径较小且TOC含量较低[11]。黄河口附近沉积物的高沉积速率(1~9 cm/a)使得有机碳含量较低的颗粒物被大量地输送至海底[20],进而对海洋沉积物中的TOC和ASs含量起到了“稀释”作用。“稀释”作用不仅体现在黄河口外围海域中,在渤海海峡附近海域也有较明显的体现。渤海海峡作为渤海与黄海相连的唯一通道,每年大约有30%黄河负载的泥沙通过海峡进入黄海。在此运输途中泥沙可能被沉积在渤海海峡附近海域,并对沉积物中TOC和ASs的含量进行了“稀释”。
渤海中的细粒径泥沙可以通过直接或再悬浮的方式被搬运至泥质区[12]。渤海西北部靠近辽东湾和西南部靠近渤海湾海域的海流多为旋转流且水动力较弱,该区域主要沉积细粒径泥沙,形成泥质区。与黄河口和渤海海峡附近海域不同的是,此泥质区沉积物中黏土含量、TOC、TN和ASs含量均表现为相对高值,这表明了黏土矿物能够吸附较多SOM。在辽东浅滩和渤中浅滩等水动力较强的海域沉积着粗颗粒物,这些比表面积较小的粗颗粒物对SOM的吸附能力较弱,因而,此区域TOC、TN和ASs含量较低。通过上述讨论可知,在讨论沉积物粒度对SOM的影响时,应注意区分河流影响大和影响小的区域。受黄河影响较大的海域,河流输入的有机碳含量较低的颗粒物的“稀释”作用是影响TOC和ASs分布的主要因素,而在黄河影响小的海域则体现出黏土矿物对SOM的富集作用。另外,渤海中SOM的分布不仅与陆源有机质的输入和水动力对沉积物的筛选有关,还可能与海洋初级生产力有关系。根据2003-2014年渤海表层叶绿素a(Chl a)的监测结果可知,海水中Chl a浓度较高的区域主要集中在沿岸海区,特别是滦河口附近海域,高Chl a浓度主要归因于海洋中藻类的暴发[21]。比较发现,黄河口附近海域表层沉积物中TOC含量明显低于滦河口附近海域。初级生产力的差异可能是造成河口临近海域沉积物中有机质含量差异的原因之一。
2.4 ASs对有机质来源和降解的指示
在渤海表层沉积物中,GlcN和GalN是含量较高的两种ASs,它们之间存在显著正相关性(图3b,R2=0.85,p < 0.01),这表明GlcN和GalN可能具有共同的来源和相似的活性。因此,GlcN/GalN的降低可能不是因为GlcN的优先降解,而是有机质来源的更替造成的。通常,富含几丁质的桡足类生物具有较高的GlcN/GalN(14.2~20.9),而富含肽聚糖的细菌具有较低的比值(~1.9)[22]。当GlcN/GalN> 8时,可判断有机质主要来源于富含几丁质的生物;而当GlcN/GalN< 3时,表明有机质主要来源于细菌源有机质[5-6, 15]。渤海中GlcN/GalN小于3,表明表层沉积物中有较强的细菌源有机质,细菌可能是ASs的主要来源,而富含几丁质的浮游生物不是ASs的主要贡献者。
AS-C%和AS-N%的值在不同类型的海洋生物体内也有所不同。在浮游植物中,AS-C%和AS-N%分别为0.1%~0.5%和0.2%~0.6%;在海洋细菌中,分别为0.3%~0.9%和0.3%~2.5%;在富含几丁质的浮游动物中,分别高达12%和7%[5]。渤海表层沉积物中AS-C%和AS-N%的平均值分别为(1.5 ± 0.7)%和(1.9 ± 0.9)%。因此,AS-C%和AS-N%在空间上的差异可能与沉积环境中生物量和生物群落的组成有关。另外,ASs在环境中一般存在于生物的结构单元(如几丁质和肽聚糖)中,不易被微生物降解,被认为是活性相对较低的一种有机物。所以,AS-C%也被用来指示有机质的降解程度,但是关于AS-C%指示降解的可靠性目前还存在着争议。Dauwe和Middelburg[23]的研究发现,ASs在降解程度深的沉积物中含量较高,即随着有机质的降解,ASs被逐渐富集,从而使得AS-C%和AS-N%的值逐渐增大[24]。然而,Niggemann和Schubert[6]的研究发现,秘鲁沿岸柱状沉积物中AS-C%和AS-N%的值随着沉积深度的增加而逐渐减小,有机质降解程度越深,ASs越枯竭,ASs相对于TOC能够被优先降解。在不同的研究中,ASs表现出不同的降解活性,这可能与研究对象处于不同的降解状态有关。在海洋有机质的降解初期,海洋中活性有机质(如氨基酸和色素)含量较为丰富,ASs更倾向于积累,AS-C%和AS-N%的值随着降解程度的加深而逐渐增大。而当活性有机质被消耗后,ASs也会被微生物降解,AS-C%和AS-N%的值随着降解程度的加深而逐渐减小。因此,AS-C%和AS-N%受到有机质来源和降解程度两方面因素的影响。
2.5 细菌贡献
细菌不仅是海洋食物链中的分解者,还是海洋有机物的生产者。MurA是细菌特有的一种AS,仅存在于细菌细胞壁的肽聚糖中,可作为细菌标志物。通过MurA的碳、氮归一化产率可以计算细菌源有机质对TOC和TN的贡献(Bacteria-C%和Bacteria-N%),计算公式如下:
$$ \begin{split} & {\rm{Bacteria}}{\text{-}}{\rm{C\text{%}\;or\;Bacteria{\text{-}}N\text{%} }} = \\&\qquad {{\rm{[MurA}}]_{{\rm{sam}}}}/{[{\rm{MurA}}]_{{\rm{{\rm{bac}}}}}} \times 100 \end{split} $$ (3) 式中:Bacteria-C% or Bacteria-N%表示的是细菌源有机质对TOC或TN的贡献;[MurA]sam和[MurA]bac分别表示沉积物样品和细菌有机质中MurA的碳、氮归一化产率。本文中,[MurA]bac在Bacteria-C%和Bacteria-N%的计算中分别是28.1 nmol/mg C和121.3 nmol/mg N[25]。根据公式(3)计算得到,渤海表层沉积物中Bacteria-C%为1.6%~29.3%,平均值为(10.7 ± 8.3)%,Bacteria-N%为2.0%~35.3%,平均值为(12.6 ± 9.6)%。不同水域沉积物中基于MurA计算得到的Bacteria-C%和Bacteria-N%列于表1,渤海表层沉积物中Bacteria-C%和Bacteria-N%与其他水域中的值相当。Bacteria-C%和Bacteria-N%具有相似的空间分布特征,其高值主要集中在渤海中部海域。该分布特征与Chen等关于渤海中细菌生物量和群落分布的调查结果一致,渤海中部沉积物是细菌反硝化的主要场所,细菌生物量明显高于沿岸海域[26]。沿岸海域中高营养盐和重金属浓度抑制了细菌的活动,导致沉积物中细菌的丰度低于中部海域[26]。另外,在细菌源有机质贡献率较高的渤海海域中,海源有机质是其主要的有机质供应来源,而海源有机质的埋藏效率较低,海源有机质被降解矿化后,细菌源有机质的重要性可能就被凸显。
表 1 不同水域沉积物中基于MurA计算的Bacteria-C%和Bacteria-N%的比较Tab. 1 Bacteria-C% and Bacteria-N% based on MurA for SOM from different aquatic environmentsMurA主要来源于细菌细胞壁中肽聚糖的复合物。肽聚糖是革兰氏阴性菌和革兰氏阳性菌细胞壁的组成成分,是由N-乙酰氨基葡萄糖和N-乙酰胞壁酸构成的双糖单位与4~5个氨基酸短肽聚合而成。肽聚糖在海水中的周转周期较短,约为10~167 d。以MurA作为细菌标志物来估算细菌源有机质的贡献主要代表了活细菌和新鲜的细菌残骸对沉积物中碳、氮的贡献,而已被部分降解的细菌源有机质往往被忽视。因此,使用MurA估算的Bacteria-C%和Bacteria-N%通常低估了细菌在海洋有机质中的贡献。
3 结 论
(1)有机碳含量较低的黄河泥沙的大量沉积可能是造成黄河口和渤海海峡附近海域表层沉积物中TOC、TN和ASs含量较低的原因。而在受河流影响较小的海域,SOM的含量可能与黏土矿物对SOM的吸附以及海洋初级生产力有关。
(2)细菌源有机质可能是渤海表层沉积物中ASs的主要来源。
(3)渤海表层沉积物中Bacteria-C%和Bacteria-N%的平均值分别为(10.7 ± 8.3)%和(12.6 ± 9.6)%,但此数值仅代表了活细菌和新鲜细菌残骸对沉积物中碳、氮的贡献。
-
表 1 不同水域沉积物中基于MurA计算的Bacteria-C%和Bacteria-N%的比较
Tab. 1 Bacteria-C% and Bacteria-N% based on MurA for SOM from different aquatic environments
-
[1] HEDGES J I, KEIL R G. Sedimentary organic matter preservation: an assessment and speculative synthesis[J]. Marine Chemistry, 1995, 49(2–3): 81-115. doi: 10.1016/0304-4203(95)00008-F
[2] 王伟伟, 付元宾, 李树同, 等. 渤海中部表层沉积物分布特征与粒度分区[J]. 沉积学报, 2013, 31(03): 478-485. [3] HU B, LI J, BI N, et al. Effect of human-controlled hydrological regime on the source, transport, and flux of particulate organic carbon from the lower Huanghe (Yellow River)[J]. Earth Surface Processes and Landforms, 2015, 40(8): 1029-1042. doi: 10.1002/esp.3702
[4] DAVIS J, KAISER K, BENNER R. Amino acid and amino sugar yields and compositions as indicators of dissolved organic matter diagenesis[J]. Organic Geochemistry, 2009, 40(3): 343-352. doi: 10.1016/j.orggeochem.2008.12.003
[5] BENNER R, KAISER K. Abundance of amino sugars and peptidoglycan in marine particulate and dissolved organic matter[J]. Limnology and Oceanography, 2003, 48(1): 118-128. doi: 10.4319/lo.2003.48.1.0118
[6] NIGGEMANN J, SCHUBERT C J. Sources and fate of amino sugars in coastal Peruvian sediments[J]. Geochimica et Cosmochimica Acta, 2006, 70(9): 2229-2237. doi: 10.1016/j.gca.2006.02.004
[7] REN C, YUAN H, SONG J, et al. Amino sugars as indicator of organic matters source and diagenesis in the surface sediments of the East China Sea[J]. Ecological Indicators, 2019, 97: 111-119. doi: 10.1016/j.ecolind.2018.10.011
[8] FERNANDES L, D SOUZA F, MATONDKAR S G P, et al. Amino sugars in suspended particulate matter from the Bay of Bengal during the summer monsoon of 2001[J]. Journal of Earth System Science, 2006, 115(3): 363-370. doi: 10.1007/BF02702048
[9] WU Q, ZHANG J, ZHANG R, et al. The source and diagenesis of sediment organic matter in the upper Pearl River Estuary as indicated by amino sugars[J]. Journal of Soils and Sediments, 2013, 13(5): 943-952. doi: 10.1007/s11368-012-0649-z
[10] LAHAJNAR N, WIESNER M G, GAYE B. Fluxes of amino acids and hexosamines to the deep South China Sea[J]. Deep Sea Research Part I: Oceanographic Research Papers, 2007, 54(12): 2120-2144. doi: 10.1016/j.dsr.2007.08.009
[11] 高立蒙, 姚 鹏, 王金鹏, 等. 渤海表层沉积物中有机碳的分布和来源[J]. 海洋学报, 2016, 38(06): 8-20. [12] 乔淑卿, 石学法, 王国庆, 等. 渤海底质沉积物粒度特征及输运趋势探讨[J]. 海洋学报(中文版), 2010, 32(4): 139-147. [13] WAN Y, HU J, AN L, et al. Determination of trophic relationships within a bohai bay food web using stable δ15N and δ13C analysis[J]. Chinese Science Bulletin, 2005, 50: 1021-1025. doi: 10.1360/04wd0283
[14] GUO Z, LI J, FENG J, et al. Compound-specific carbon isotope compositions of individual long-chain n-alkanes in severe Asian dust episodes in the North China coast in 2002[J]. Chinese Science Bulletin, 2006, 51(17): 2133-2140. doi: 10.1007/s11434-006-2071-7
[15] GUPTA L P, KAWAHATA H. Amino acid and hexosamine composition and flux of sinking particulate matter in the equatorial Pacific at 175°E longitude[J]. Deep Sea Research Part I: Oceanographic Research Papers, 2000, 47(10): 1937-1960. doi: 10.1016/S0967-0637(00)00009-1
[16] UNGER D, GAYE-HAAKE B, NEUMANN K, et al. Biogeochemistry of suspended and sedimentary material in the Ob and Yenisei rivers and Kara Sea: amino acids and amino sugars[J]. Continental Shelf Research, 2005, 25(4): 437-460. doi: 10.1016/j.csr.2004.09.014
[17] MEYERS P A. Organic geochemical proxies of paleoceanographic, pale-olimnologic, and paleoclimatic processes[J]. Organic Geochemistry, 1997, 27(5): 213-250.
[18] 陈沛沛, 刘素美, 张桂玲, 等. 黄河下游营养盐浓度、入海通量月变化及“人造洪峰”的影响[J]. 海洋学报(中文版), 2013, 35(02): 59-71. [19] CHEN Y, YANG G, JI C, et al. Sources and degradation of sedimentary organic matter in the mud belt of the East China Sea: Implications from the enantiomers of amino acids[J]. Organic Geochemistry, 2018, 116: 51-61. doi: 10.1016/j.orggeochem.2017.11.011
[20] 李凤业, 高 抒, 贾建军, 等. 黄、渤海泥质沉积区现代沉积速率[J]. 海洋与湖沼, 2002, 33(04): 364-369. doi: 10.3321/j.issn:0029-814X.2002.04.004 [21] FU Y, XU S, LIU J. Temporal-spatial variations and developing trends of Chlorophyll-a in the Bohai Sea, China[J]. Estuarine, Coastal and Shelf Science, 2016, 173: 49-56. doi: 10.1016/j.ecss.2016.02.016
[22] OGAWA H, AMAGAI Y, KOIKE I, et al. Production of refractory Ddissolved organic matter by bacteria[J]. Science, 2001, 292(5518): 917-920. doi: 10.1126/science.1057627
[23] DAUWE B, MIDDELBURG J J. Amino acids and hexosamines as indicators of organic matter degradation state in North Sea sediments[J]. Limnology and Oceanography, 1998, 43(5): 782-798. doi: 10.4319/lo.1998.43.5.0782
[24] KHODSE V B, BHOSLE N B. Distribution, origin and transformation of amino sugars and bacterial contribution to estuarine particulate organic matter[J]. Continental Shelf Research, 2013, 68: 33-42. doi: 10.1016/j.csr.2013.08.004
[25] KAISER K, BENNER R. Major bacterial contribution to the ocean reservoir of detrital organic carbon and nitrogen[J]. Limnology and Oceanography, 2008, 53(1): 99-112. doi: 10.4319/lo.2008.53.1.0099
[26] CHEN Q, FAN J, MING H, et al. Effects of environmental factors on denitrifying bacteria and functional genes in sediments of Bohai Sea, China[J]. Marine Pollution Bulletin, 2020, 160: 111621. doi: 10.1016/j.marpolbul.2020.111621
[27] BOURGOIN L, TREMBLAY L. Bacterial reworking of terrigenous and marine organic matter in estuarine water columns and sediments[J]. Geochimica et Cosmochimica Acta, 2010, 74(19): 5593-5609. doi: 10.1016/j.gca.2010.06.037
[28] CARSTENS D, SCHUBERT C J. Amino acid and amino sugar transformation during sedimentation in lacustrine systems[J]. Organic Geochemistry, 2012, 50: 26-35. doi: 10.1016/j.orggeochem.2012.06.006
-
期刊类型引用(1)
1. 郑天昊,袁华茂,宋金明,贺志鹏,段丽琴,李学刚. 氨基糖对中国东部边缘海表层沉积物中有机质来源和降解的指示作用. 海洋科学. 2024(11): 21-31 .  百度学术
百度学术
其他类型引用(2)



 下载:
下载: