The nitrogen distribution and phytoplankton uptake rates in the wintertime at Dongzhai estuary
-
摘要:
近年来,因人类活动导致的大量活性氮通过河口输入近海,沿海地区的富营养化和有害藻华问题日益加剧。深入研究河口系统中氮营养盐的分布以及浮游植物对不同形式氮营养盐的吸收偏好,对揭示藻华暴发机制和陆源超额氮管理具有重要意义。本研究于2022年12月在海南省东寨港河口开展了环境因子和氮营养盐浓度调查,并通过15N同位素示踪实验,定量分析了浮游植物对尿素(Urea-N)、铵氮(NH4+)、硝酸盐(NO3−)和亚硝酸盐(NO2−)的吸收速率。结果表明,冬季东寨港水体溶解态氮营养盐浓度沿河口向外海递减,浓度排序为NO3− > NH4+ > NO2− > Urea-N,其浓度范围分别为5.84~49.78 µmol/L、1.16~40.64 µmol/L、0.83~2.98 µmol/L、0.25~0.98 µmol/L。浮游植物氮吸收速率排序为NH4+ > Urea-N > NO3− > NO2−,其范围分别为46.6~280.1 nmol/L/h、4.7~21.3 nmol/L/h、1.1~9.8 nmol/L/h和0.03~3.4 nmol/L/h。浮游植物对氮的相对偏好指数(the relative preference index,RPI)结果表明,还原态氮(NH4+和Urea-N)的偏好[RPI(NH4+)和RPI(Urea-N)范围分别为2.11~7.95和1.92~4.34]显著高于氧化态氮(NO3−和NO2−)[RPI(NO3−)和RPI(NO2−)均小于1]。在中、低盐度区域,浮游植物对Urea-N的偏好有时会超过NH4+,即RPI(Urea-N)/RPI(NH4+) > 1。本研究表明,东寨港河口冬季水体溶解态氮中以氧化态的NO3−为主,但浮游植物更偏好利用还原态氮。此外,对于还原态氮而言,上游浮游植物对Urea-N的偏好可能较NH4+更高。本研究结果丰富了对小型河口浮游植物不同形态氮吸收的认识。
Abstract:In recent years, due to human activities, a large amount of active nitrogen (N) has been transported into estuaries and coasts, causing eutrophication and harmful algal blooms. Understanding the distribution of different forms of N in estuarine systems and the relative preference of phytoplankton for different N forms is of great practical significance for the algal bloom mechanism exploration and the effective excess N management. In December 2022, environmental parameters and different forms of nitrogen concentrations were investigated in the Dongzhai estuary, Hainan Province. By using the 15N labelling technique, incubation experiments were carried out to quantify the phytoplankton uptake rates of Urea-N, ammonium (NH4+), nitrate (NO3−) and nitrite (NO2−). The results showed that dissolved N concentrations in the water of Dongzhai estuary decreased along the river to the offshore in winter. The order of N concentration was NO3− > NH4+ > NO2− > Urea-N, which ranged from 5.84−49.78 µmol/L, 1.16−40.64 µmol/L, 0.83−2.98 µmol/L and 0.25−0.98 µmol/L, respectively. The order of N uptake rates was NH4+ > Urea-N > NO3− > NO2−, which ranged from 46.6−280.1 nmol/L/h, 4.7−21.3 nmol/L/h, 1.1−9.8 nmol/L/h, and 0.03−3.4 nmol/L/h, respectively. Phytoplankton preferred reducing N (NH4+ and urea-N), more specifically, the value of relative preference index (RPI) of NH4+ [RPI(NH4+)] and urea-N [RPI(Urea-N)] is 2.11−7.95 and 1.92−4.34, respectively, higher than the relative preference of oxidizing N (NO3− and NO2−) [both RPI(NO3−) and RPI(NO2−) were < 1]. At the sampling stations with low and medium salinity, the preference for Urea-N sometimes exceeded that for NH4+, i.e., RPI(Urea-N)/RPI(NH4+) > 1. The study suggests that NO3− is the main dissolved N forms in Dongzhai estuary in winter, but phytoplankton prefers to utilize reduced N. Moreover, phytoplankton living in the upstream may have a higher preference for Urea-N than NH4+. Our study enriches the understanding of different forms of N uptake by phytoplankton in the small estuary.
-
氮是浮游植物生长和繁殖的重要营养元素,是水生生态系统生产力和食物网的重要支撑。然而近年来由于人口增长、氮肥施用增加、养殖产业规模扩大,全球范围内氮富集现象日益严重,并引发近海生物栖息地退化和有害藻华等环境问题[1]。近海水体中总溶解氮(total dissolved nitrogen,TDN)是活性氮的重要组成形态,包含溶解无机氮[dissolved inorganic nitrogen,DIN,由铵氮(NH4+)、硝酸盐(NO3−)和亚硝酸盐(NO2−)构成]和溶解有机氮[dissolved organic nitrogen,DON,包括尿素(Urea-N)、氨基酸、蛋白质等]。广义上,DIN和具有生物可利用性的DON都可被认为是氮营养盐。浮游植物作为水生生态系统的初级生产者,在基础物质(营养盐和有机物)的循环和生态系统健康维持方面起着重要作用[2]。水体中氮营养盐的组成、浓度变化及其相对利用率,被认为是影响浮游植物类群生长和水体生产力的重要因素。从20世纪60年代到21世纪最初十年,中国近海区域,如胶州湾、渤海、长江口、珠江口及厦门海域,无机氮浓度呈增加态势[3]。同时水体中营养盐结构失衡,使得有害藻华发生频次增多、范围扩大(如东海近岸海域出现的硅藻和甲藻赤潮),以及浮游植物优势种发生变化(如渤海水域由1990年前“硅藻占优”演变至2000年后“硅甲藻联合为主”)[4]。南海近岸海域是我国典型赤潮高发区之一,藻华灾害对海水养殖业产生不良影响,也使得生态安全和人类健康受到威胁[4]。为了应对这一系列问题,亟待深入探讨藻华的发生机制,这对指导科学建立河口−近海海水环境监测体系也尤为重要。
海南东寨港位于海南省东北部,属于热带海洋性气候。东寨港区域现存大约2000 ha红树林保护区[5]、1570 ha滩涂和水域[6]、70 ha坑塘及咸淡水养殖区[7],有演丰西河、演丰东河、三江河(罗雅河)、演州河、珠溪河5条淡水河汇入东寨港河口。入港河流水质较差,2021-2023年珠溪河河口干季(1月)断面水质类别为地表水Ⅴ类或劣Ⅴ类,为中度或重度污染(文昌市环境监测站)[8-10],其他4条河流在干季(11月)均为地表水Ⅲ类或Ⅳ类(海口市生态环境局)[11-13]。东寨港河口水域同时受纳高密度养殖塘的养殖废水,也承载周边城镇未经分级处理的生活污水[5-7]。东寨港保护区水域受到氮、磷污染,有机污染曾达4级,并促发富营养化、藻华暴发、浮游动物(团水虱)数量暴增等不容忽视的生态环境灾害,河口生态系统遭到一定程度的破坏[14-15]。东寨港水域DIN浓度范围差异较大,2009-2016年,东寨港受增养殖影响区域水体年平均DIN浓度范围为3.57~41.43 μmol/L(0.05~0.58 mg N/L),2009-2010年和2012-2013年DIN浓度均超标(单因子标准指数法),高于第Ⅱ类海水水质标准[15]。东寨港河口浮游植物种类组成丰富,2021年3-4月东寨港水域共鉴定出6门215种浮游植物,包括绿藻门、硅藻门、裸藻门、蓝藻门、甲藻门和隐藻门,平均浮游植物多样性指数为1.4~3.0[16]。同时,东寨港河口水体浮游植物丰度高(> 103 cells/mL),干湿季节都以真核浮游植物为主[17]。然而,目前对东寨港保护区水域的氮营养盐存在形态以及浮游植物氮吸收速率未有系统研究。通过浮游植物对不同形态氮源的利用及偏好的研究,有助于了解浮游植物对水体氮污染情况的响应,并为控制源头氮输入提供科学参考。
本研究聚焦浮游植物对氮营养盐的吸收速率,通过调查东寨港DIN和Urea-N浓度,以分析氮营养盐在东寨港河口的分布特征;并同步量化氮营养盐吸收速率以及与环境因子间的相关性,探讨热带河口浮游植物对不同形态氮源的偏好。
1 材料与方法
1.1 调查区域和采样
东寨港河口为漏斗状的半封闭式河口,其西北部连通铺前海(图1)。东寨港河口区域年均温度为24.5 ℃,年平均降雨量为1816 mm,三分之二的雨水集中在湿季(夏、秋季)[18]。2022年12月降雨量较低,仅有9.4 mm,约为1981-2010年12月历史平均降水量(34.3 mm,中央气象台)的四分之一。受不规则半日潮影响,东寨港河口水体盐度(Salinity)为0~33[17],无明显季节变化。
![]() 图 1 东寨港河口站点水文、生物、氮营养盐和氮吸收速率平面分布注:由于ZXR站点Chl a浓度、PN浓度、营养盐(NO3−、NH4+、DIN、Urea-N)浓度、NH4+及DIN吸收速率远超其他站点,在图中用红色空心三角标出(数据见表2)Fig. 1 Distribution of hydrological, biological, dissolved N concentrations, dissolved N uptake rates at Dongzhai estuary
图 1 东寨港河口站点水文、生物、氮营养盐和氮吸收速率平面分布注:由于ZXR站点Chl a浓度、PN浓度、营养盐(NO3−、NH4+、DIN、Urea-N)浓度、NH4+及DIN吸收速率远超其他站点,在图中用红色空心三角标出(数据见表2)Fig. 1 Distribution of hydrological, biological, dissolved N concentrations, dissolved N uptake rates at Dongzhai estuary本研究于2022年12月23日在东寨港河口水域(地理坐标为东经110°54′-110°64′,北纬19°92′-20°05′)进行调查,在河流(珠溪河,ZXR站)−河口−近海区域设置15个采样站点(表1)。河流淡水端(本研究ZXR站位)水体样本的温度(WT)和盐度使用手持式多参数水质分析仪(WTW,Multi 3630 IDS Set F)现场测量,河口−近海采样站位WT和盐度使用温盐深剖面仪(CTD,OCEAN SEVEN 316 Plus)获取。用5 L亚克力采水器采集表层水样(0.5 m),样品经200 μm孔径筛绢预过滤后装入20 L聚碳酸酯(PC)采水桶中,避光保存带回实验室。收集经0.22 μm孔径的聚醚砜过滤器过滤的水样,置于−20 ℃冷冻保存,用于后续溶解态氮浓度测定[19]。同步使用450 ℃预烧5 h的25 mm Whatman GF/F滤膜过滤0.2~0.4 L水样,收集滤膜,保存于−80 ℃超低温冰箱,用于后续进行总悬浮颗粒物(total suspended matter,TSM)、颗粒态氮(particulate nitrogen,PN)和叶绿素a(Chl a)浓度的测定。
表 1 东寨港河口采样站点经纬度及相关信息Tab. 1 Latitude and longitude of sampling station at Dongzhai estuary and related information
站点纬度 经度 采样时间 盐度 P1 20.05°N 110.56°E 12:27 30.90 P2 20.04°N 110.56°E 12:19 30.40 P3 20.03°N 110.57°E 12:10 29.60 DZ1 20.02°N 110.58°E 12:00 27.50 DZ2 20.01°N 110.59°E 11:36 25.70 DZ3 20.01°N 110.60°E 10:17 19.20 DZ4 20.00°N 110.59°E 9:53 28.10 DZ5 20.00°N 110.60°E 9:45 28.40 DZ6 19.99°N 110.60°E 9:34 27.70 DZ7 19.97°N 110.61°E 9:25 28.50 DZ8 19.96°N 110.61°E 9:13 25.70 DZ9 20.02°N 110.61°E 11:16 18.50 DZ10 20.03°N 110.62°E 11:05 16.90 DZ11 20.03°N 110.63°E 10:52 22.40 ZXR 20.03°N 110.64°E 10:08 0.10 1.2 化学和生物参数分析
1.2.1 Urea-N和DIN浓度测定
Urea-N浓度基于丁二酮肟(diacetyl monoxime,DAM)显色原理进行定量[20],NH4+浓度采用靛酚蓝分光光度法测定,并对盐度/pH效应进行校正获得[21]。Urea-N和NH4+浓度均使用紫外可见分光光度计(UV-1800型, 上海美谱达, 中国)进行测定,检测限分别为0.1 µmol/L和0.5 µmol/L。NO3−和NO2−浓度测定原理为重氮−偶氮分光光度法,采用营养盐自动分析仪(AA3 HR,SEAL Analytical,Germany)进行测定,NO3−先经铜−镉柱还原为NO2−,然后在酸性介质中与磺胺发生重氮反应,其产物与萘乙二胺盐酸盐耦合生成红色偶氮染料,在543 nm波长下测定,检测限分别为0.07 µmol/L和0.02 µmol/L[22]。
1.2.2 TSM、PN和Chl a浓度测定
GF/F滤膜经冷冻干燥后,进行称重,扣除空白滤膜质量并除以过滤体积,得到TSM浓度(mg/L)。称重后的滤膜经1N HCl酸化烘干后,通过元素分析−稳定同位素比值质谱仪(EA-IRMS;Thermo EAIsolink,253Plus,Thermo Fisher,USA)测量PN浓度(µmol/L)和氮同位素值(δ15NPN,‰)[23]。用于测定Chl a浓度的滤膜用新配制的浓度为95%(体积比)的丙酮避光置于−20 ℃萃取16~20 h后,用荧光仪(Turner Trilogy,USA)测定浓度[24]。
1.3 15N同位素示踪吸收实验
浮游植物对DIN和Urea-N的吸收速率,通过添加15N标记的NH4Cl、NaNO3、NaNO2和Urea-N示踪剂(Sigma-Aldrich)后经一定条件培养来获取。具体流程为:水样经200 µm孔径筛绢预过滤混匀后,分装于250 mL PC瓶中,每个站位分装12瓶水样,3个为一组。向4组培养瓶中依次添加15N-NH4Cl、15N-NaNO3、15N-NaNO2和15N-Urea,添加的终浓度分别为0.19 µmol/L、0.49 µmol/L、0.14 µmol/L和0.04 µmol/L,添加量与对应的环境底物占比分别为1%~14%(平均值7%)、1%~8%(平均值4%)、5%~14%(平均值9%)和4%~14%(平均值9%)。添加结束后盖紧瓶盖摇匀,每组立即取一个样品进行过滤,收集GF/F滤膜后保存[作为浮游植物氮吸收速率计算所用的初始(t0)PN浓度和δ15N的样品]。余下样品置于模拟采样期间日均温度和光照强度(4.00~30.60 Einstein/m2/day)的光照培养箱中进行培养。经4~6 h培养,采取同样过滤方式,将250 mL样品收集于Whatman GF/F滤膜并保存滤膜(作为浮游植物氮吸收速率计算所用的终点t1时刻的PN浓度和δ15NPN的样品)。滤膜在测试分析前均冷冻保存于−80 ℃超低温冰箱。测试分析时,滤膜经冷冻干燥后,用元素分析−稳定同位素比值质谱仪(EA-IRMS)测量PN浓度及δ15N。培养体系总的氮吸收速率(nmol/L/h)参照公式(1)计算[25]:
$$ {\rho }_{\mathrm{b}\mathrm{u}\mathrm{l}\mathrm{k}}=\frac{\left[P{N}_{t}\right]\times \left({r}_{t}-{r}_{0}\right)}{T\times \left({r}_{s}-{r}_{0}\right)} $$ (1) 式中:[PNt]代表t时刻颗粒态氮浓度(nmol/L);rt和r0分别代表产物PN在培养结束和初始时刻的15N比例(r值,$ r=\dfrac{^{15}\mathit{\mathrm{N}}}{^{15}\mathrm{N}+^{14}\mathrm{N}} $);T代表培养时间;rs代表示踪剂添加后初始时刻培养体系中底物(Urea-N/NH4+ /NO3−/NO2−)15N的比例。根据公式(1),可得到示踪剂添加后培养体系中某一特定底物氮对应的总的吸收速率($ {\rho }_{\mathrm{b}\mathrm{u}\mathrm{l}\mathrm{k}} $, nmol/L/h),包括Urea-N、NH4+、NO3−、NO2−吸收速率,分别用UU、AU、NaU和NiU表示。依据培养体系中原位底物环境浓度(Sin situ)和添加后体系中总底物浓度(Sin situ + Sadd)的比值[Sin situ/( Sin situ + Sadd)],换算到对应原位环境底物浓度下的吸收速率ρin situ($ {\rho }_{\mathrm{i}\mathrm{n}\mathrm{ }\mathrm{ }\mathrm{ }\mathrm{ }\mathrm{ }\mathrm{ }\mathrm{s}\mathrm{i}\mathrm{t}\mathrm{u}}=\dfrac{{\rho }_{\mathrm{b}\mathrm{u}\mathrm{l}\mathrm{k}}\times {S}_{\mathrm{i}\mathrm{n}\mathrm{ }\mathrm{ }\mathrm{ }\mathrm{ }\mathrm{ }\mathrm{ }\mathrm{ }\mathrm{ }\mathrm{s}\mathrm{i}\mathrm{t}\mathrm{u}}}{{S}_{\mathrm{i}\mathrm{n}\mathrm{ }\mathrm{ }\mathrm{ }\mathrm{ }\mathrm{ }\mathrm{ }\mathrm{ }\mathrm{ }\mathrm{s}\mathrm{i}\mathrm{t}\mathrm{u}}+{S}_{\mathrm{a}\mathrm{d}\mathrm{d}}} $)。公式(1)中的r值可根据同位素比值质谱测定得到的δ15N(‰)进行换算获得。换算过程如下:
$$ {\text{δ}}^{15}{\mathrm{N}}\left(\text{‰}\right)=\left(\frac{{R}_{\mathrm{s}\mathrm{a}\mathrm{m}\mathrm{p}\mathrm{l}\mathrm{e}}}{{R}_{\mathrm{s}\mathrm{t}\mathrm{a}\mathrm{n}\mathrm{d}\mathrm{a}\mathrm{r}\mathrm{d}}}-1\right)\times 1000 $$ (2) $$ R=\frac{{}^{15}{\mathrm{N}}}{{}^{14}{\mathrm{N}}}=\frac{r}{r-1} $$ (3) $$ r=\frac{(\dfrac{\text{δ}^{15}\mathrm{N}}{1000}+1)\times R_{\mathrm{s}\mathrm{t}\mathrm{a}\mathrm{n}\mathrm{d}\mathrm{a}\mathrm{r}\mathrm{d}}}{(\dfrac{\text{δ}^{15}\mathrm{N}}{1000}+1)\times R_{\mathrm{s}\mathrm{t}\mathrm{a}\mathrm{n}\mathrm{d}\mathrm{a}\mathrm{r}\mathrm{d}}+1} $$ (4) 式中:Rstandard是大气氮气中的15N/14N,为0.36765%[26]。
水体环境中氮形态多样,浮游植物在吸收氮以供自身生长时可能存在不同利用偏好。Mccarthy等[27]提出相对偏好指数(relative preference index,RPI),用以比较浮游植物对不同形态氮源的偏好程度,即当某种氮源的RPI大于1时,代表浮游植物会更加偏好此种氮源;反之,RPI小于1,则代表不倾向利用该氮源。
$$ RPI\left(\mathrm{A}\right)=\frac{\rho \left(\mathrm{A}\right)}{\rho \left(\mathrm{N}\right)}\Big/\frac{c\left(\mathrm{A}\right)}{c\left(\mathrm{N}\right)} $$ (5) 式中:ρ(A)是NH4+、NO3−、NO2−和Urea-N中某一特定氮A对应的环境浓度下的原位吸收速率;ρ(N)是浮游植物对NH4+、NO3−、NO2−和Urea-N这4种氮营养盐的吸收速率之和;c(A)是某一特定氮A的环境浓度;c(N)是NH4+、NO3−、NO2−和Urea-N的环境浓度之和。
1.4 数据处理与分析方法
本文数据可视化绘图采用Prism 9和Origin 2023软件进行,并通过Origin 2023 Spearman检验进行相关性分析。采用SPSS 26软件进行显著性差异分析,其中,不同组间差异采用单因素方差分析(ANOVA),p < 0.05表示有显著差异。
2 结果与讨论
2.1 环境因子和不同形态氮分布
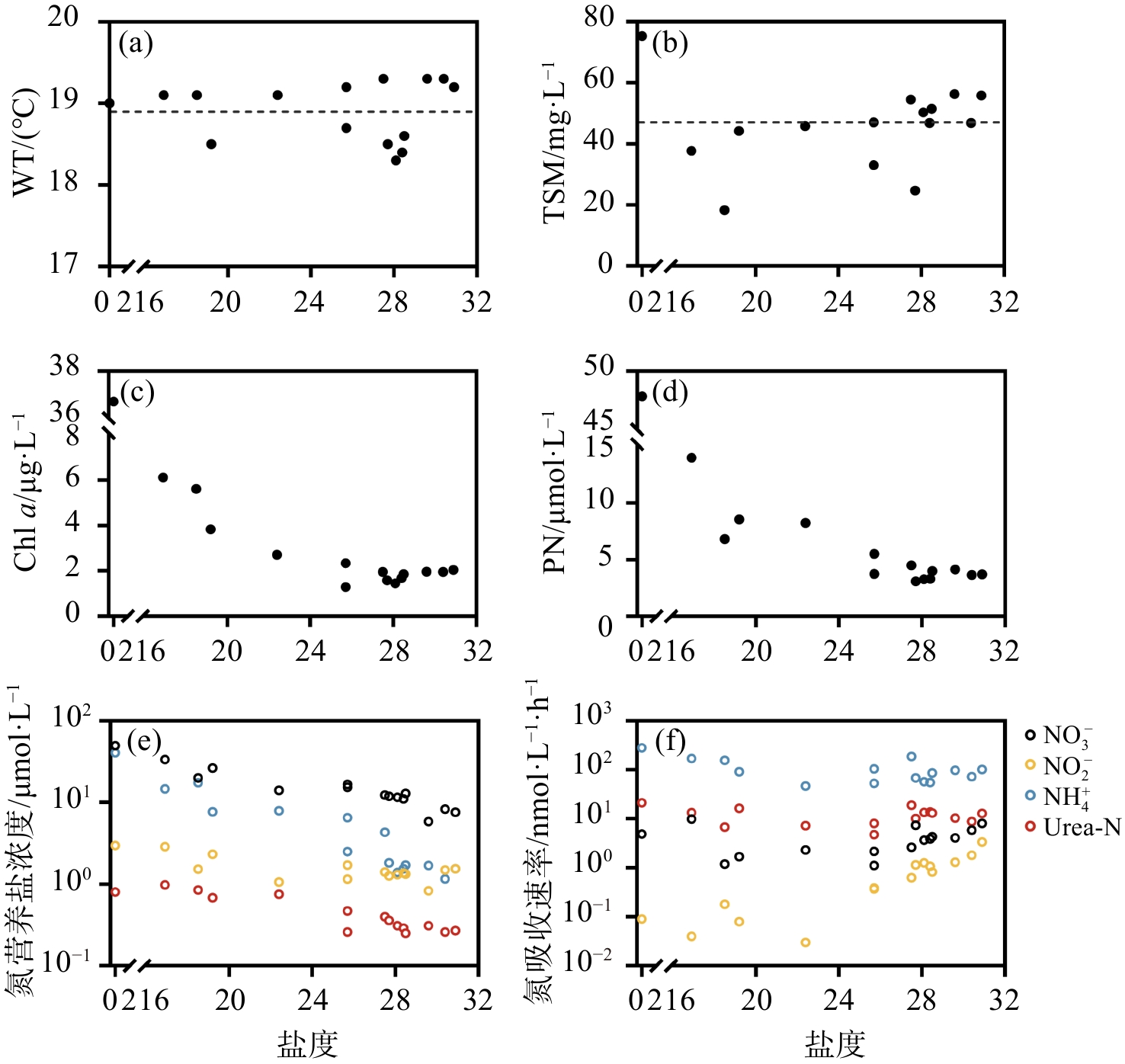
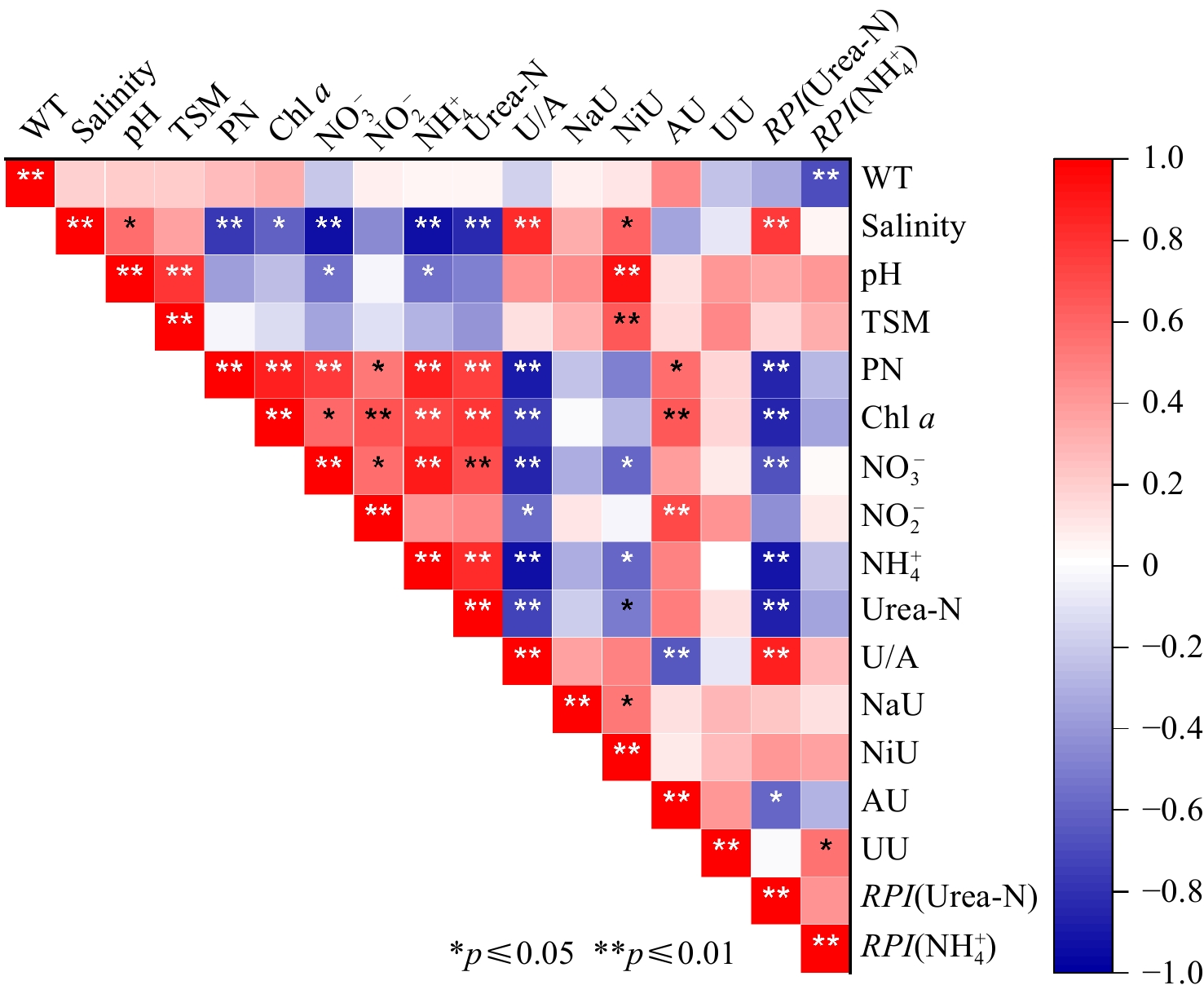
本研究区域盐度范围为0.1~30.9,其中ZXR站为淡水河站点,盐度最低。水体盐度沿东寨港南部及珠溪河流域向北部外海逐渐升高(图1a)。采样期间WT范围为18.3 ℃~19.3 ℃,平均值为(18.9±0.4)℃(图2a,表2)。由于船行航线由南至北,采样时间较早的站点水体吸收日照时间短(表1),故而南部站点WT稍低于北部站点(图1b,表2)。TSM浓度平均值为(45.88±13.76)mg/L(图2b),TSM浓度最高的站点为ZXR站点(75.3 mg/L)(图1c)。Chl a浓度在ZXR站最高(36.66 µg/L),并随盐度上升呈下降趋势(图2c)。从地理分布上来说,珠溪河下游站点(DZ9—DZ11)的Chl a浓度[(平均值为(4.82±1.84)µg/L]显著高于东寨港河口其他站点[平均值为(1.99±0.68)µg/L](p < 0.05)(图1d)。同Chl a浓度分布趋势类似,PN浓度在ZXR站最高,为47.78 µmol/L。除ZXR站点外其他站点PN浓度为3.09~13.99 µmol/L(图2d),其中,珠溪河流域下游站点(DZ3及DZ9—DZ11)PN浓度为6.81~13.99 µmol/L(平均值为9.40 µmol/L),显著高于其他站点(3.09~5.51 µmol/L,平均值为3.89 µmol/L)(p < 0.05)(图1e)。
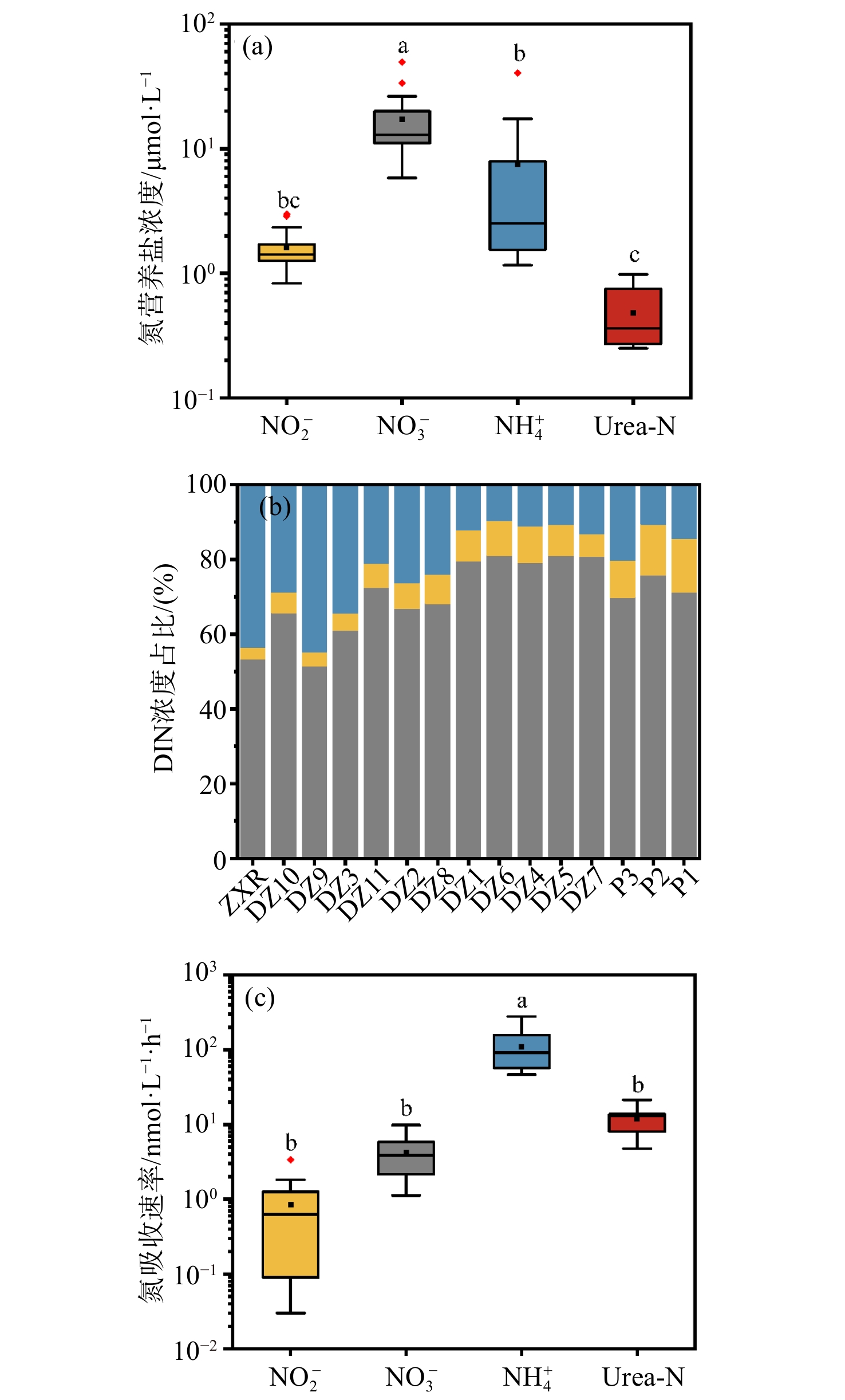
表 2 东寨港河口水文、生物、营养盐浓度、吸收速率Tab. 2 Relevant parameters of hydrology, biological, dissolved N concentrations, dissolved N uptake rates at Dongzhai estuary站点 WT/℃ Chl a/µg·L−1 PN/µM DIN/µM NO3−/µM NO2−/µM NH4+/µM Urea-N/µM NaU/nM·h−1 NiU/nM·h−1 AU/nM·h−1 UU/nM·h−1 P1 19.20 2.04 3.70 10.67 7.59 1.54 1.54 0.27 8.05 3.36 101.51 12.92 P2 19.30 1.95 3.64 10.92 8.27 1.49 1.16 0.26 5.85 1.81 72.30 8.80 P3 19.30 1.96 4.13 8.36 5.84 0.83 1.69 0.31 4.09 1.30 97.91 10.34 DZ1 19.30 1.95 4.50 18.06 12.31 1.41 4.34 0.40 2.62 0.63 188.08 18.95 DZ2 19.20 2.34 5.51 24.89 16.66 1.71 6.52 0.47 1.12 0.37 104.35 8.04 DZ3 18.50 3.83 8.55 36.35 26.33 2.33 7.69 0.68 1.69 0.08 90.97 16.36 DZ4 18.30 1.45 3.26 14.28 11.58 1.31 1.39 0.31 3.68 1.26 57.03 13.49 DZ5 18.40 1.68 3.31 13.98 11.07 1.37 1.54 0.29 3.87 1.07 54.98 13.77 DZ6 18.50 1.58 3.09 15.00 11.92 1.26 1.82 0.36 7.40 1.15 68.23 10.19 DZ7 18.60 1.85 3.98 15.99 12.95 1.33 1.71 0.25 4.34 0.82 86.00 13.14 DZ8 18.70 1.28 3.74 19.02 15.36 1.15 2.51 0.26 2.16 0.39 52.75 4.74 DZ9 19.10 5.62 6.81 38.88 19.97 1.53 17.38 0.85 1.19 0.18 156.22 6.77 DZ10 19.10 6.12 13.99 51.21 33.64 2.87 14.70 0.98 9.84 0.04 170.01 13.36 DZ11 19.10 2.71 8.23 23.02 14.06 1.06 7.90 0.75 2.32 0.03 46.61 7.27 ZXR 19.00 36.66 47.78 93.40 49.78 2.98 40.64 0.80 4.91 0.09 280.06 21.30 平均值 18.91 4.87 8.28 26.27 17.16 1.61 7.50 0.48 4.21 0.84 108.47 11.96 std 0.36 8.92 11.32 22.12 11.58 0.63 10.46 0.26 2.61 0.89 64.48 4.61 Chl a浓度、PN浓度与氮营养盐浓度均呈显著正相关关系(p < 0.05, 图3),表明氮营养盐浓度是影响浮游植物生长和生物量的重要因素。水体中氮营养盐浓度随盐度增加呈下降趋势(图2e),其中NO3−、NH4+和Urea-N浓度都与盐度呈显著负相关关系(p<0.01, 图3),表明东寨港海水受到河流输入营养盐的影响。水体中氮营养盐浓度的排序为NO3− > NH4+ > NO2− > Urea-N,浓度范围分别为5.84~49.78 µmol/L、1.16~40.64 µmol/L、0.83~2.98 µmol/L、0.25~0.98 µmol/L(图2e)。NO3−浓度显著高于其他氮营养盐的浓度(p < 0.05)(图4a),其浓度占DIN浓度的50%~80%(图4b),是主要的DIN存在形式。NO2−浓度比NO3−浓度低一个数量级,大多数站点的NO2−浓度为1~2 µmol/L(图1g和图2e)。NO2−浓度占DIN的浓度百分比在珠溪河支流流轴站点(东西向,ZXR→DZ2,占比范围为3.19%~6.41%)比东寨港内和近海站点(南北向,DZ8→P1,占比范围为6.05%~14.43%)低(图4b)。NH4+平均浓度(7.50 µmol/L)高于NO2−,NH4+浓度占DIN浓度百分比的范围为9.8%~45%(图4b)。
总的来说,东寨港河口冬季DIN浓度范围为8.36~51.21 µmol/L(除河流ZXR站点),平均值为21.47 µmol/L。东寨港河口冬季平均DIN浓度处在中国沿海其他海湾枯水期DIN浓度的中间水平,如莱州湾[2021年3月,(11.65±14.70)µmol/L][28]、象山港[2006年4月,(51.98±4.45)µmol/L][29]、大亚湾[2019年11月,平均值为(5.50±3.96)µmol/L][30]、湛江湾[(2020年11月,平均值为27.14 µmol/L)[31]、广东海陵湾(2017年11月,平均值为30.71 μmol/L)[32]。海湾周边人类活动强度等输入来源的差异可能是近海区域DIN浓度存在差别的重要因素。从地理分布看,东寨港区域海水质量差别较大。珠溪河沿岸低盐站点(DZ3、DZ9、DZ10)DIN浓度(36.35~51.21 µmol/L)劣于《海水水质标准》(GB3097-1997)中四类海水标准(> 0.5 mg N/L),中盐站点(DZ1—DZ2、DZ4—DZ8、DZ11)水质(DIN浓度范围为13.98~24.89 µmol/L)达到第二、三类海水标准,东寨港外高盐站点(P1—P3)水质(DIN浓度范围为8.36~10.92 µmol/L)优于国家第一类海水标准(< 0.2 mg N/L,即< 14.3 µmol/L)[33]。平均Urea-N浓度为(0.48±0.26)µmol/L,显著低于几种DIN的浓度(p < 0.05, 图4a)。东寨港河口Urea-N浓度在世界近岸、河口和河流(0.020~23.40 µmol/L)中处于较低水平[34],仅为同季节大亚湾[(平均值为(1.57±0.49)µmol/L)][35]的三分之一、九龙江口[平均值为(2.46±0.86)µmol/L][36]及海口湾[平均值为(2.34±0.97)µmol/L][37]的五分之一。大亚湾、九龙江近岸农业用地面积分别为59.98 km2[38]和59.81 km2[39]。海口湾近岸无大面积农业用地,但海口市大量生活污水和工业废水排入此海域。相较而言,东寨港近岸区域为红树林保护区,耕地面积小,渔业养殖区也仅占70 ha(0.7 km2),人类活动影响相较其他河口海湾小,这可能是该区域水体Urea-N浓度水平相对偏低的原因。
2.2 浮游植物对DIN和Urea-N的吸收
本研究通过15N稳定同位素示踪剂添加培养实验,获得了冬季东寨港河口浮游植物对DIN和Urea-N的吸收速率,吸收速率由大至小排序为NH4+、Urea-N、NO3−、NO2−(图2f和图4c)。浮游植物对NH4+的吸收速率(AU)范围为46.6~280.1 nmol/L/h(图2f和图4c),其平均值为108.5 nmol/L/h,显著高于对另外3种氮营养盐的吸收速率(p < 0.01,图4c)。PN浓度和Chl a浓度与AU呈显著正相关关系(p < 0.05,图3),说明浮游植物主要以NH4+为氮源维持生长。浮游植物对NO3−和NO2−的吸收速率分别为1.1~9.8 nmol/L/h(平均值为4.2 nmol/L/h)和0.03~3.4 nmol/L/h(平均值为0.84 nmol/L/h)(图2f和图4c)。NO3−吸收速率(NaU)与环境因子无显著关系(p > 0.05,图3)。NO2−吸收速率(NiU)与NH4+浓度、Urea-N浓度、NO3−浓度呈显著负相关关系,与盐度呈显著正相关关系(p < 0.05,图3),说明NH4+等氮源浓度高的时候,浮游植物对NO2−的吸收可能受到抑制,而在高盐区域其他氮源浓度相对低的时候,浮游植物对NO2−的利用增加。Urea-N的吸收速率(UU)范围为4.7~21.3 nmol/L/h,与NaU、NiU在组间统计学上无显著差异(图4c,p > 0.05),但UU平均值(12.0 nmol/L/h)约为NaU平均值的3倍、NiU平均值的14倍。底物是影响速率的关键因素之一,因此水体中较高浓度的Urea-N可能是造成UU较高的原因之一。然而,UU和Urea-N浓度之间未有统计学上显著的相关性(p > 0.05,图3),且在Urea-N浓度较低的高盐水域UU仍维持在较高水平(图2f和图4c),说明有其他因素介入浮游植物对Urea-N的吸收过程并产生影响,这可能是由于不同浮游藻类细胞内氮素转运蛋白和同化酶活性的差异所导致的[40],后续可以对UU的调控因素进行进一步研究。
2.3 不同形态氮吸收相对偏好
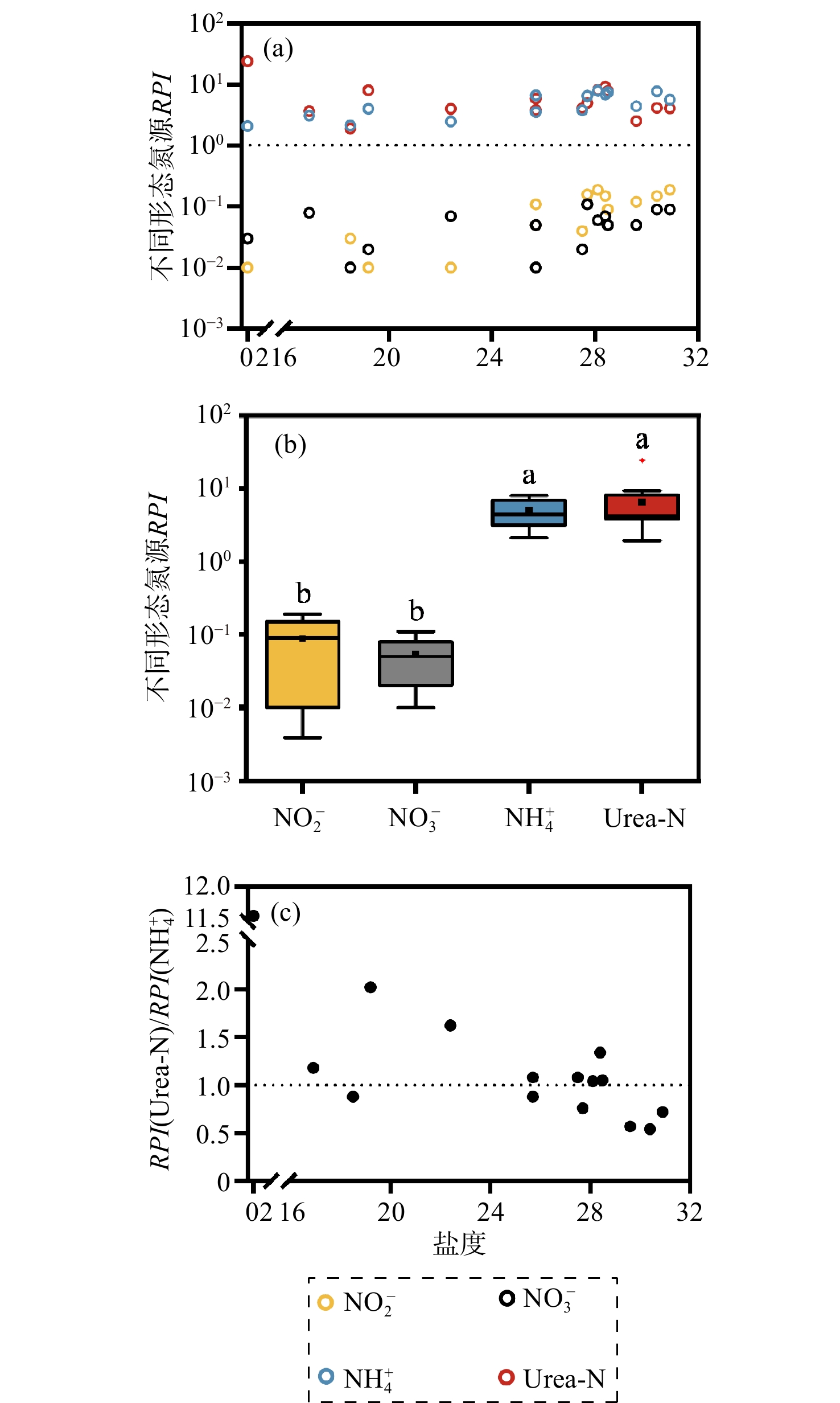
本研究显示,RPI(NO2−)和RPI(NO3−)均小于1,RPI(NH4+)和RPI(Urea-N)均大于1(图5a)。氧化态氮的RPI显著低于还原态氮(p < 0.05,图5b),说明浮游植物对NH4+和Urea-N有更高的吸收偏好性,这与浮游植物优先利用还原态氮的研究结果一致(因为还原态氮可以使用较少能量参与物质传递)[31,41]。在高盐端站点RPI(NO2−)大于RPI(NO3−)(图5a和图5b),表明在氮营养盐底物浓度相对较低的海域,浮游植物相对于NO3−更偏好NO2−,这可能是因为浮游植物吸收NO2−所需的能量较小。但NiU低于NaU,可能是由于环境水体中NO2−浓度较NO3−更低。RPI(NO2−)和RPI(NO3−)由上游淡水向下游海端呈增加趋势(图5a),这可能是由于在营养盐浓度整体较低的海端,浮游植物必须利用多种氮源以满足生长。
对于浮游植物相对偏好的还原态氮,RPI(Urea-N)与RPI(NH4+)的比值[RPI(Urea-N)/RPI(NH4+)]在超过一半的站点大于1(图5c)。表明在冬季东寨港的大部分水域,浮游植物对Urea-N的偏好程度不亚于NH4+,显示出Urea-N作为浮游植物氮源的重要性。在中国其他海湾的研究也发现了Urea-N在支撑浮游植物生长中的重要作用。例如,2022年秋季胶州湾的氮加富实验结果显示,浮游植物对Urea-N的利用强于对NH4+和NO3−的利用[42]。2016年10月在大亚湾的研究发现,添加Urea-N促进了浮游植物群落中小粒级(nano-和pico-)Chl a浓度和甲藻的比例增加[43]。海南岛南北5个近岸海湾春季的研究发现,Urea-N一定程度上促进近岸海域甲藻生长,可能是因为甲藻更适应高Urea-N和DON浓度的环境[44]。另外,在盐度较高的站点(包括铺前海站点P1、P2、P3)RPI(Urea-N)/RPI(NH4+)小于1,表明高盐海域的浮游植物群落更偏好将NH4+作为氮源。这种差异可能源于浮游植物群落结构的差异[45]。2021年3月-4月,东寨港河口中高盐度水域的优势种为硅藻,主要由耐盐种如菱形藻(Nitzschia sp.)、小环藻(Cyclotella sp.)、新月拟菱形藻(Nitzschiella closterium)组成[16]。有研究显示某些硅藻(如中肋骨条藻)更偏好NH4+[46]。但目前东寨港港内及临海浮游植物群落组成空间分布相关研究很少,未来的研究应进一步探讨浮游植物组成与不同氮源利用的地理空间关系。
2.4 Urea-N在藻华暴发中潜在的重要性
当前,受水体富营养化影响,藻华暴发已成为我国近海生态系统面临的主要环境问题之一。藻华暴发时藻体大量生长繁殖致使水体变色,遮蔽光照,影响其他生物的生命活动。同时,藻种间竞争加剧,优势种挤占生态位,降低系统内生物多样性。溶解氧因有机物的分解和矿化而被大量消耗,水中甚至出现缺氧现象。藻类消亡产生大量不同形式的营养盐以及硫化氢和甲烷等有害物质,改变海水化学环境,使营养盐结构和生物地球化学循环过程发生变化,可能导致优势种向有害藻种演替或者发生其他次生灾害。过去几十年,全球氮肥的使用以及氮肥中Urea-N比例的显著增加,使得河口、近海水体中Urea-N浓度也相应升高,Urea-N作为浮游植物氮源的作用受到了越来越多的关注。当以Urea-N为氮源时,一些有毒有害藻类的毒性甚至会增强,因此一些河口与近海的藻华事件也常与DON特别是Urea-N联系起来[34,47]。例如,在美国加利福尼亚州Newport海滩进行的研究显示,Urea-N在多边舌甲藻(Lingulodinium polyedrum)藻华期间约承担了38%的氮源[47],在蒙特雷湾旋沟藻(Cochlodinium. spp)赤潮期间则更多(55%~62%)[48]。澳大利亚亚热带Morcton湾的研究发现,Urea-N在氮营养盐中的占比同时与甲藻丰度及甲藻在浮游植物群落中的占比显著相关[34]。针对中国厦门同安湾的赤潮藻种血红哈卡藻(Akashiwo sanguinea)的研究发现,血红哈卡藻对Urea-N的亲和力高于NH4+,在Urea-N浓度为0~100 μmol/L的范围内均可促进其生长[49]。在海南北部海口湾进行的研究说明,冬、春季水温、脲酶活性以及Urea-N浓度的升高有利于海湾浮游植物(硅藻和甲藻)的生长[37]。本研究显示,以Urea-N为代表的DON在冬季东寨港河口初级生产过程中扮演了重要角色,说明该研究海域可能存在偏好Urea-N的浮游植物,浮游植物在河流−河口−近海可能因氮源的组成比例差异存在群落组成的演替现象。未来研究需要进一步结合浮游植物的群落组成和不同形态氮利用的偏好关系,厘清不同类型浮游植物的暴发生长机制。
3 结 论
(1)冬季东寨港河口水体DIN以NO3−为主。Urea-N、NH4+浓度由珠溪河向外海和港内变化幅度较大;NO3−、NH4+、NO2−和Urea-N浓度范围分别为5.84~49.78 µmol/L、1.16~40.64 µmol/L、0.83~2.98 µmol/L和0.25~0.98 µmol/L,其分布受到潮汐和人类活动影响。
(2)浮游植物对NH4+的吸收速率为46.6~280.1 nmol/L/h,显著高于Urea-N吸收(4.7~21.3 nmol/L/h)、NO3−吸收(1.1~9.8 nmol/L/h)和NO2−吸收(0.03~3.4 nmol/L/h)。浮游植物的氮吸收过程除受理化因子影响外,也与生物因子等因素相关。
(3)在冬季东寨港河口区域,浮游植物对Urea-N偏好不亚于NH4+,表明Urea-N也是浮游植物生长的重要氮源。DON利用可能在藻华暴发机制中具有重要作用。
致谢:感谢航次过程中尚李华、符友飞、全鑫等队员协助采样。
-
图 1 东寨港河口站点水文、生物、氮营养盐和氮吸收速率平面分布
注:由于ZXR站点Chl a浓度、PN浓度、营养盐(NO3−、NH4+、DIN、Urea-N)浓度、NH4+及DIN吸收速率远超其他站点,在图中用红色空心三角标出(数据见表2)
Fig. 1. Distribution of hydrological, biological, dissolved N concentrations, dissolved N uptake rates at Dongzhai estuary
表 1 东寨港河口采样站点经纬度及相关信息
Tab. 1 Latitude and longitude of sampling station at Dongzhai estuary and related information
站点纬度 经度 采样时间 盐度 P1 20.05°N 110.56°E 12:27 30.90 P2 20.04°N 110.56°E 12:19 30.40 P3 20.03°N 110.57°E 12:10 29.60 DZ1 20.02°N 110.58°E 12:00 27.50 DZ2 20.01°N 110.59°E 11:36 25.70 DZ3 20.01°N 110.60°E 10:17 19.20 DZ4 20.00°N 110.59°E 9:53 28.10 DZ5 20.00°N 110.60°E 9:45 28.40 DZ6 19.99°N 110.60°E 9:34 27.70 DZ7 19.97°N 110.61°E 9:25 28.50 DZ8 19.96°N 110.61°E 9:13 25.70 DZ9 20.02°N 110.61°E 11:16 18.50 DZ10 20.03°N 110.62°E 11:05 16.90 DZ11 20.03°N 110.63°E 10:52 22.40 ZXR 20.03°N 110.64°E 10:08 0.10 表 2 东寨港河口水文、生物、营养盐浓度、吸收速率
Tab. 2 Relevant parameters of hydrology, biological, dissolved N concentrations, dissolved N uptake rates at Dongzhai estuary
站点 WT/℃ Chl a/µg·L−1 PN/µM DIN/µM NO3−/µM NO2−/µM NH4+/µM Urea-N/µM NaU/nM·h−1 NiU/nM·h−1 AU/nM·h−1 UU/nM·h−1 P1 19.20 2.04 3.70 10.67 7.59 1.54 1.54 0.27 8.05 3.36 101.51 12.92 P2 19.30 1.95 3.64 10.92 8.27 1.49 1.16 0.26 5.85 1.81 72.30 8.80 P3 19.30 1.96 4.13 8.36 5.84 0.83 1.69 0.31 4.09 1.30 97.91 10.34 DZ1 19.30 1.95 4.50 18.06 12.31 1.41 4.34 0.40 2.62 0.63 188.08 18.95 DZ2 19.20 2.34 5.51 24.89 16.66 1.71 6.52 0.47 1.12 0.37 104.35 8.04 DZ3 18.50 3.83 8.55 36.35 26.33 2.33 7.69 0.68 1.69 0.08 90.97 16.36 DZ4 18.30 1.45 3.26 14.28 11.58 1.31 1.39 0.31 3.68 1.26 57.03 13.49 DZ5 18.40 1.68 3.31 13.98 11.07 1.37 1.54 0.29 3.87 1.07 54.98 13.77 DZ6 18.50 1.58 3.09 15.00 11.92 1.26 1.82 0.36 7.40 1.15 68.23 10.19 DZ7 18.60 1.85 3.98 15.99 12.95 1.33 1.71 0.25 4.34 0.82 86.00 13.14 DZ8 18.70 1.28 3.74 19.02 15.36 1.15 2.51 0.26 2.16 0.39 52.75 4.74 DZ9 19.10 5.62 6.81 38.88 19.97 1.53 17.38 0.85 1.19 0.18 156.22 6.77 DZ10 19.10 6.12 13.99 51.21 33.64 2.87 14.70 0.98 9.84 0.04 170.01 13.36 DZ11 19.10 2.71 8.23 23.02 14.06 1.06 7.90 0.75 2.32 0.03 46.61 7.27 ZXR 19.00 36.66 47.78 93.40 49.78 2.98 40.64 0.80 4.91 0.09 280.06 21.30 平均值 18.91 4.87 8.28 26.27 17.16 1.61 7.50 0.48 4.21 0.84 108.47 11.96 std 0.36 8.92 11.32 22.12 11.58 0.63 10.46 0.26 2.61 0.89 64.48 4.61 -
[1] GLIBERT P M, MARANGER R, SOBOTA D J, et al. The Haber Bosch-harmful algal bloom (HB-HAB) link[J]. Environmental Research Letters, 2014, 9(10): 105001. doi: 10.1088/1748-9326/9/10/105001
[2] 张增虎, 唐丽丽, 张永雨. 海洋中藻菌相互关系及其生态功能[J]. 微生物学通报, 2018, 45(9): 2043-2053. [3] 傅婷婷, 陈宝红, 暨卫东, 等. 中国近海营养盐含量和结构的时空变化及其影响[C]//福建省海洋学会2014年学术年会暨福建省科协第十四届学术年会分会场论文集. 福州: 福建省海洋学会, 2014: 865-871. [4] 邢建伟, 宋金明, 袁华茂, 等. 我国近海生态环境灾害发生的生源要素驱动机制及健康调控[J]. 应用生态学报, 2024, 35(2): 564-576. [5] 田 蜜, 钟才荣, 方赞山, 等. 基于多源遥感的东寨港不同模式退塘还林红树林演变分析[J]. 湿地科学与管理, 2023, 19(3): 4-8. doi: 10.3969/j.issn.1673-3290.2023.03.01 [6] 林雪云. 浅谈东寨港保护区的资源保护及管理对策[J]. 热带林业, 2019, 47(4): 62-65. [7] 辜晓虹, 邱彭华, 陈 卫, 等. 海口东寨港自然保护区红树林变化及其与周边社区关联分析[J]. 热带地理, 2023, 43(1): 43-58. [8] 文昌市生态环境局. 2021年入海河流入海断面水质状况[EB/OL]. (2022-01-29)[2024-4-17]. http://wenchang.hainan.gov.cn/wcssthjbhj/c100248/202201/0d1b3bb045c24847a7ffd72112692e65.shtml. [9] 文昌市生态环境局. 2022年入海河流入海断面水质状况[EB/OL]. (2022-04-12) [2024-4-17]. http://wenchang.hainan.gov.cn/wcssthjbhj/c100248/202204/c93f5d4e4a724e3bb78b12890f85203b.shtml?ddtab=true. [10] 文昌市生态环境局. 2023年入海河流入海断面水质状况[EB/OL]. (2022-04-12) [2024-4-17]. http://wenchang.hainan.gov.cn/wcssthjbhj/c100248/202304/73a8880cc83d49f8aa50cde0ee0e386d.shtml?ddtab=true. [11] 海口市生态环境局. 2021年第四季度河长制监测数据[EB/OL]. (2022-01-06) [2024-4-17]. http://sthb.haikou.gov.cn/ztlm_7241/zdlyxxgk/shjjcxx/hzzjcsj/202201/t817949.shtml. [12] 海口市生态环境局. 2022年第四季度河长制监测数据[EB/OL]. (2023-01-13) [2024-4-17]. http://sthb.haikou.gov.cn/ztlm_7241/zdlyxxgk/shjjcxx/hzzjcsj/202301/t1221735.shtml. [13] 海口市生态环境局. 2023年第四季度河长制监测数据[EB/OL]. (2024-01-18) [2024-4-17]. http://sthb.haikou.gov.cn/ztlm_7241/zdlyxxgk/shjjcxx/hzzjcsj/202403/t1348841.shtml. [14] 王焕熙, 王耀山. 东寨港自然保护区五个监测站水质变化特征分析[J]. 热带林业, 2022, 50(2): 60-64. doi: 10.3969/j.issn.1672-0938.2022.02.013 [15] 李仕平, 李 仙, 张光磊, 等. 东寨港海水增养殖区水质状况及变化趋势研究[J]. 海南师范大学学报(自然科学版), 2017, 30(4): 430-435. [16] MUTETHYA E M. 海口市江东新区河流及东寨港水质、重金属和浮游物群落评价[D]. 海口: 海南大学, 2023: 54-67. [17] 石彭兰, 王强俊, 谭佐莉, 等. 冬季东寨港微微型浮游植物丰度、分布及影响因素[J]. 海洋与湖沼, 2023, 54(4): 1058-1069. [18] 曾祥云. 海南东寨港红树林湿地水生生态系统健康评价研究[D]. 广州: 华南理工大学, 2015: 10, 22-24. [19] REED M H, STROPE E K, CREMONA F, et al. Effects of filtration timing and pore size on measured nutrient concentrations in environmental water samples[J]. Limnology and Oceanography: Methods, 2023, 21(1): 1-12. doi: 10.1002/lom3.10529
[20] CHEN L, MA J, HUANG Y, et al. Optimization of a colorimetric method to determine trace urea in seawater[J]. Limnology and Oceanography: Methods, 2015, 13(6): 303-311. doi: 10.1002/lom3.10026
[21] PAI S C, TSAU Y J, YANG T I. pH and buffering capacity problems involved in the determination of ammonia in saline water using the indophenol blue spectrophotometric method[J]. Analytica Chimica Acta, 2001, 434(2): 209-216. doi: 10.1016/S0003-2670(01)00851-0
[22] DAI M, WANG L, GUO X, et al. Nitrification and inorganic nitrogen distribution in a large perturbed river/estuarine system: the Pearl River Estuary, China[J]. Biogeosciences, 2008, 5(5): 1227-1244. doi: 10.5194/bg-5-1227-2008
[23] Intergovernmental Oceanographic Commission. Protocols for the joint global ocean flux study (JGOFS) core measurements[R]. Paris: UNESCO, 1994.
[24] WELSCHMEYER N A. Fluorometric analysis of chlorophyll a in the presence of chlorophyll b and pheopigments[J]. Limnology and Oceanography, 1994, 39(8): 1985-1992. doi: 10.4319/lo.1994.39.8.1985
[25] DUGDALE R C, WILKERSON F P. The use of 15N to measure nitrogen uptake in eutrophic oceans; experimental considerations[J]. Limnology and Oceanography, 1986, 31(4): 673-689. doi: 10.4319/lo.1986.31.4.0673
[26] SIGMAN D M, FRIPIAT F. Nitrogen isotopes in the ocean[J]. Encyclopedia of Ocean Sciences (Third Edition), 2019, 1: 263-278.
[27] MCCARTHY J J, TAYLOR W R, TAFT J L. Nitrogenous nutrition of the plankton in the Chesapeake Bay. 1. Nutrient availability and phytoplankton preferences[J]. Limnology and Oceanography, 1977, 22(6): 996-1011. doi: 10.4319/lo.1977.22.6.0996
[28] 梁生康, 李姗姗, 马浩阳, 等. 基于陆海同步调查的莱州湾营养盐时空分布及限制因子分析[J]. 中国海洋大学学报(自然科学版), 2022, 52(8): 97-110. [29] 吕华庆, 常抗美, 石钢德. 象山港氮、磷营养盐环流和分布规律的研究[J]. 海洋与湖沼, 2009, 40(2): 138-144. doi: 10.3321/j.issn:0029-814X.2009.02.005 [30] 马 玉, 王 翔, 许 欣, 等. 大亚湾水体营养盐分布特征及其生态环境效应[J]. 中国环境监测, 2023, 39(6): 110-122. [31] 周 敏. 2017-2020年秋季湛江湾海表叶绿素a和营养盐时空分布及潜在富营养化研究[D]. 湛江: 广东海洋大学, 2021: 11-14. [32] 唐俊逸, 秦 民, 刘晋涛, 等. 海陵湾营养盐分布特征及其富营养化评价[J]. 海洋湖沼通报, 2022, 44(3): 93-100. [33] 国家环境保护局. 海水水质标准: GB 3097–1997 [S]. 北京:环境科学出版社,2004. [34] GLIBERT P M, HARRISON J, HEIL C, et al. Escalating worldwide use of urea—a global change contributing to coastal eutrophication[J]. Biogeochemistry, 2006, 77(3): 441-463. doi: 10.1007/s10533-005-3070-5
[35] 张 云, 黄凯旋, 欧林坚, 等. 大亚湾海域尿素与浮游生物脲酶活性研究[J]. 热带海洋学报, 2014, 33(1): 90-96. doi: 10.3969/j.issn.1009-5470.2014.01.012 [36] TANG J M, XU M N, LIN Y X, et al. The biological transformation of ammonium and urea in a eutrophic estuarine system in Southern China[J]. Frontiers in Marine Science, 2022, 9: 1040554. doi: 10.3389/fmars.2022.1040554
[37] 黄凯旋, 张 云, 欧林坚, 等. 海南岛南北近岸海湾浮游生物对尿素的生物可利用性比较研究[J]. 海洋科学, 2014, 38(10): 76-82. doi: 10.11759/hykx20130628001 [38] 蒋婧媛, 徐姗楠, 黄洪辉, 等. 基于L-THIA模型与3S技术的大亚湾陆域非点源总氮污染研究[J]. 应用海洋学学报, 2019, 38(4): 558-568. doi: 10.3969/J.ISSN.2095-4972.2019.04.011 [39] 周 榕. 湿地资源遥感动态监测研究——以九龙江河口为例[J]. 林业勘察设计, 2015(1): 157-161. doi: 10.3969/j.issn.1004-2180.2015.01.038 [40] SOLOMON C M. Urea uptake and urease activity in the Chesapeake Bay[J]. Journal of Marine Research, 2019, 77(Suppl 1): 139-168.
[41] XU M N, WU Y H, ZHANG X, et al. Diel change in inorganic nitrogenous nutrient dynamics and associated oxygen stoichiometry along the Pearl River Estuary[J]. Water Research, 2022, 222: 118954. doi: 10.1016/j.watres.2022.118954
[42] 赵可歆, 李晓娇, 陆庆沅, 等. 几种典型氮源加富培养对胶州湾浮游植物群落结构的影响[J]. 海洋环境科学, 2023, 42(1): 131-140. [43] 向晨晖, 刘甲星, 柯志新, 等. 大亚湾浮游植物粒级结构和种类组成对淡澳河河口水加富的响应[J]. 热带海洋学报, 2021, 40(2): 49-60. doi: 10.11978/2020040 [44] 黄凯旋, 张 云, 欧林坚, 等. 春季海南岛近岸海域尿素与浮游生物的脲酶活性[J]. 生态学报, 2013, 33(15): 4575-4582. [45] 郜培怡, 李克强, 陈 衎, 等. 氮形态组成对海洋浮游植物群落结构的影响与动力学研究[J]. 中国海洋大学学报(自然科学版), 2021, 51(5): 57-71. [46] HUANG K X, FENG Q L, ZHANG Y, et al. Comparative uptake and assimilation of nitrate, ammonium, and urea by dinoflagellate Karenia mikimotoi and diatom Skeletonema costatum s. l. in the coastal waters of the East China Sea[J]. Marine Pollution Bulletin, 2020, 155: 111200. doi: 10.1016/j.marpolbul.2020.111200
[47] KUDELA R M, COCHLAN W P. Nitrogen and carbon uptake kinetics and the influence of irradiance for a red tide bloom off southern California[J]. Aquatic Microbial Ecology, 2000, 21(1): 31-47.
[48] KUDELA R M, RYAN J P, BLAKELY M D, et al. Linking the physiology and ecology of Cochlodinium to better understand harmful algal bloom events: a comparative approach[J]. Harmful Algae, 2008, 7(3): 278-292. doi: 10.1016/j.hal.2007.12.016
[49] 王 康. 典型近岸海域尿素的时空分布以及血红哈卡藻对不同氮源的响应[D]. 厦门: 自然资源部第三海洋研究所, 2019: 46-52.





 下载:
下载: